Dipóly
pochopit podstatu noncovalent interactions, musíme se nejprve vrátit do kovalentní vazby a ponořit se do předmětu dipóly. Mnoho z kovalentní vazby, které jsme viděli – mezi dvěma uhlíky, například, nebo mezi uhlíkem a vodíkem zahrnovat přibližně stejné sdílení elektronů mezi dvěma atomy v bond. V těchto příkladech mají dva atomy přibližně stejnou elektronegativitu. Připomeňme z obecné chemie samozřejmě, že elektronegativita odkazuje na „sílu atomu v molekule přitahovat k sobě elektrony“ (to je definice nabízených Linus Pauling, významný 20. století Americký chemik, který byl primárně zodpovědný za rozvoj mnoha lepení pojmy, které jsme se učili).
Nicméně, docela často v organické chemii jsme se vypořádat s kovalentní vazby mezi dvěma atomy s různými electronegativities, a v těchto případech sdílení elektronů se nerovná: více elektronegativní jádro přitáhne dva elektrony blíž. Například ve vazbě uhlík-kyslík alkoholu jsou dva elektrony v sigma vazbě drženy blíže kyslíku než uhlíku, protože kyslík je výrazně elektronegativnější než uhlík. Totéž platí pro vazbu kyslík-vodík, protože vodík je o něco méně elektronegativní než uhlík a mnohem méně elektronegativní než kyslík.
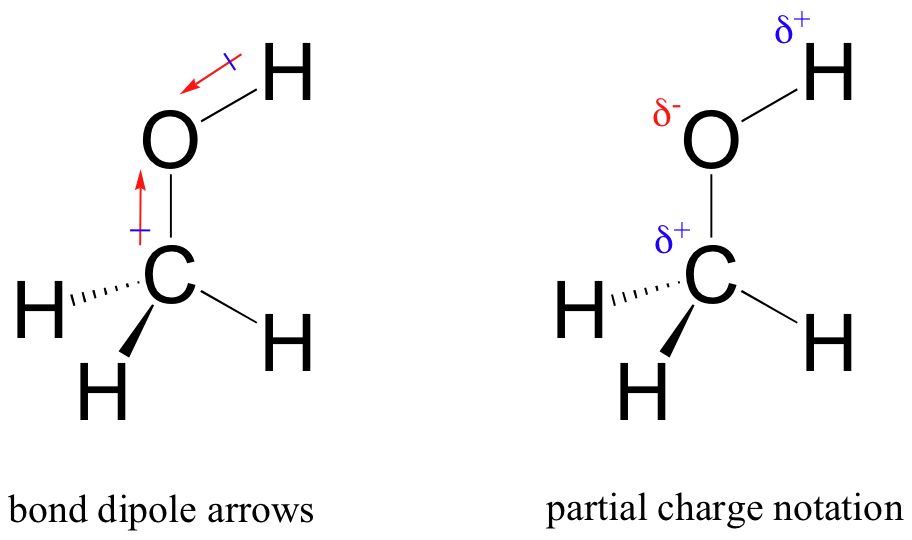
výsledkem tohoto nerovného sdílení je to, čemu říkáme dipól vazby, který existuje v polární kovalentní vazbě. Dipól vazby má záporné i kladné konce nebo póly, kde hustota elektronů je nižší (kladný pól) a vyšší (záporný pól). Rozdíl v elektronové hustotě lze vyjádřit pomocí řeckého písmene delta pro označení „částečného kladného“ a „částečného záporného“ náboje na atomech. „Dipólové šipky“, s kladným znaménkem na ocasu, se také používají k označení negativního směru (vyšší elektronové hustoty) dipólu.
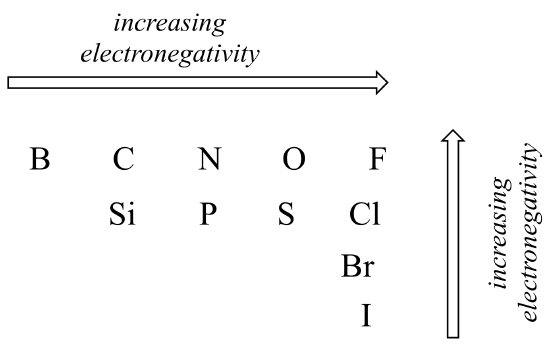
stupeň polarity v kovalentní vazbě závisí na rozdílu elektronegativity mezi těmito dvěma atomy. Elektronegativita je periodický trend: zvyšuje se zleva doprava přes řadu periodické tabulky prvků a také se zvyšuje, když se pohybujeme nahoru po sloupci. Proto je kyslík elektronegativnější než dusík, což je zase elektronegativnější než uhlík. Kyslík je také elektronegativnější než síra. Fluor, v pravém horním rohu periodické tabulky, je nejvíce elektronegativní z prvků. Vodík je o něco méně elektronegativní než uhlík.
v Periodické trendy v elektronegativity
Cvičení 2.26
Pomocí toho, co si o atomové orbitaly, racionalizovat periodické trendy v elektronegativitě. Proč se zvyšuje zleva doprava a snižuje se shora dolů? To je dobrá otázka, kterou si můžete promluvit se spolužáky a instruktorem nebo lektorem.
řešení cvičení
většina molekul obsahuje polární i nepolární kovalentní vazby. V závislosti na umístění polárních vazeb a vazebné geometrii mohou molekuly vlastnit čistou polaritu, nazývanou molekulární dipólový moment. Voda, jak si pravděpodobně vzpomínáte, má dipólový moment, který je výsledkem kombinovaných dipólů dvou vazeb kyslík-vodík. Fluormethan má také dipólový moment.
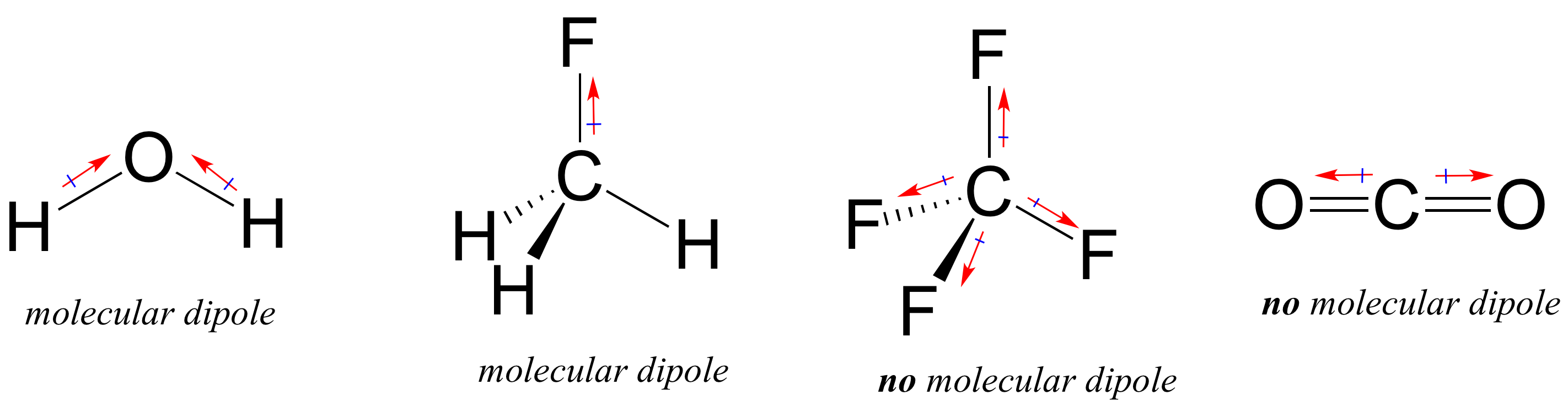
Tetrafluoromethane, nicméně, má čtyři polární vazby, které vytáhnout rovnoměrně do čtyř rohů tetahedron, což znamená, že i když tam jsou čtyři dluhopisů dipóly neexistuje žádný celkový molekulární dipólový moment. Oxid uhličitý také postrádá molekulární dipólový moment.
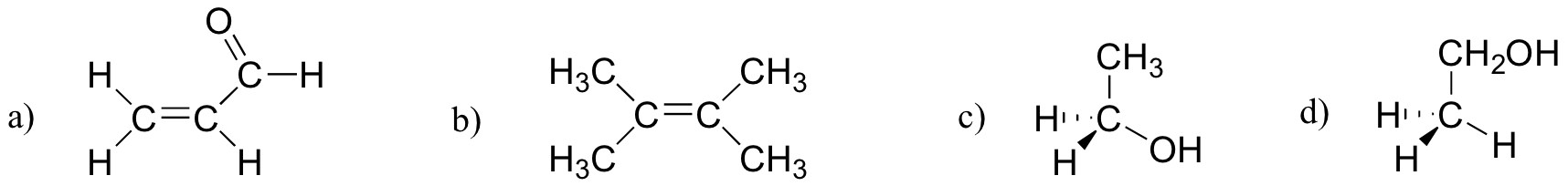
cvičení 2.27
která z níže uvedených molekul má molekulární dipólové momenty?
řešení cvičení