Fakta, Shrnutí & Definice
- adduct je produkt tvořen kromě reakce
- Adukty mohou být pouze vytvořeny z reaktantů, které mají více vazeb, jako alkenů a karbonylové skupiny,
- Adukty mohou být vytvořeny prostřednictvím dvou typů adiční reakce: elektrofilní a nucleophilic
- Adukty často tvoří mezi lewisovými kyselinami a Lewisovou bází
Co je adduct?
adukt je produkt vytvořený na konci adiční reakce. Jedná se o reakci, při které reagují dvě nebo více molekul a kombinují se za vzniku jednoho většího produktu. Tento typ reakce může dojít pouze mezi chemické sloučeniny, které mají více vazeb – sloučeniny, jako alkenů (dvojné vazby) a alkynů (triple dluhopisy). Karbonylové (C=O) a představit (C=N) skupiny mohou také podstoupit kromě reakcí, a tak tvoří adukty.
Jak se tvoří adukty?
jak již bylo zmíněno, addukty se vytvářejí adičními reakcemi. Při tomto typu reakce se dvojná vazba částečně zlomí, když reagující molekula napadne a přidá se. Níže uvedená reakce ukazuje adiční reakci mezi ethenem a bromem.

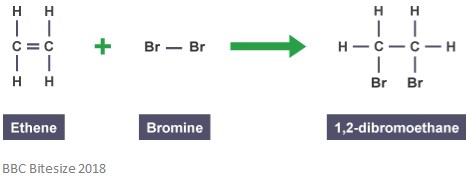
adduct v této reakci je 1,2-dibromethan. Je to proto, že se jedná o odlišný druh, který obsahuje všechny atomy všech složek.
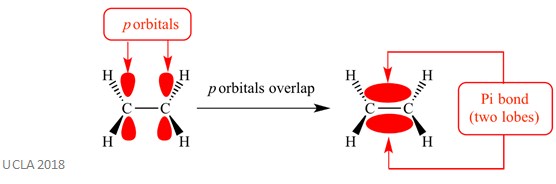
tyto adiční reakce obvykle zahrnují vazby pi (π). Jedná se o komplexní typ vazby, ve které se orbitaly p na sousedních atomech překrývají – právě toto překrývání způsobuje vazbu pi. K tomu dochází kolmo na jakékoli sigma vazby mezi těmito dvěma stejnými atomy. Tato vazba pi má také dva orbitální laloky-jeden je nad rovinou vazby sigma a druhý je pod rovinou vazby sigma. Vazba pi je znázorněna na následujícím obrázku.

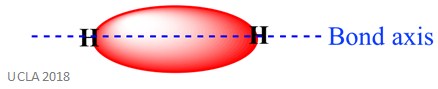
stejná reakce může také zahrnovat sigma (σ) dluhopisy. Jedná se o typ kovalentní formy vazby překrytím atomových orbitalů podél osy vazby – jinými slovy podél linie, která spojuje dva vázané atomy. Například sigma vazba v atomu vodíku je tvořena překrytím dvou orbitalů 1s – jednoho z každého atomu vodíku. To je lépe znázorněno na obrázku níže-červená oblast zobrazovala vazbu sigma.

Existují dva hlavní typy adiční reakce: elektrofilní sčítání a nucleophilic addition.
Elektrofilní Toho
elektrofilní adiční reakce je typ reakce, ve které dluhopis je rozbité, a dva nové dluhopisy jsou tvořeny. Jak bylo uvedeno výše, reaktant musí mít dvojnou nebo trojnou vazbu – elektrofil se v tomto případě přidává k vazbě pi. Jedná se o adiční reakci, a tak se v procesu nic neztratí-všechny atomy nalezené v molekulách reaktantu se nacházejí také v aduktu.

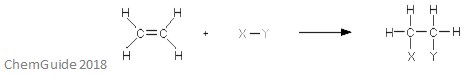
výše uvedený obrázek ukazuje základní o elektrofilní adiční reakce. Jak vidíte, všechny atomy v reaktantech se nacházejí v aduktu.
Nucleophilic Toho
nucleophilic kromě reakce je typ reakce, ve kterých dvojná vazba je rozbité, a dvě jednoduché vazby jsou tvořeny. Elektronově deficitní (elektrofilní) dvojná nebo trojná vazba reaguje s něčím, co je elektronově bohaté (nukleofil). Nukleofil se v tomto případě přidává k vazbě pi. Příklad nukleofilní adiční reakce je uveden níže.

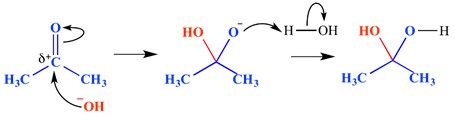
V tomto příkladu, sodný ion přidal do delta pozitivní end karbonylové skupiny – se tvořil oxyanionic tetraedrický meziprodukt molekuly. Konečným výsledkem je tedy přidání vody přes vazbu pi karbonylové skupiny.
Lewisovy kyseliny a Lewisovy báze
adukty se často tvoří mezi Lewisovými kyselinami a Lewisovými bázemi. Vytvořená molekula se nazývá Adukt Lewisovy acidobazické báze(nebo komplex Lewisovy acidobazické báze). Bez současné ztráty skupiny), Lewis-acid a Lewis-báze reakce nemohou být substitučního druhu.
dobrým příkladem je reakce mezi THF a BH3, která je znázorněna na obrázku níže. Jak uvidíte, tyto adukty Lewisovy acid-Lewisovy báze jsou zobrazeny tečkami-představují elektrony.

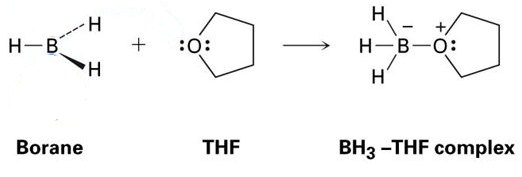
Jak můžete vidět, jediný produkt, tvořen je BH3-THF komplex, což znamená, že je adduct.
tyto typy reakcí lze také znázornit šipkami-tyto šipky představují darování elektronů z báze na kyselinu. Stejná reakce je uvedena níže, ale se šipkami označujícími darování elektronů.

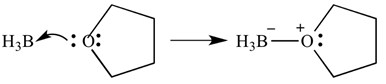
je důležité si uvědomit, že tyto šipky mají dva ‚ostny‘ na špičatý konec. To znamená, že byl darován pár elektronů. Pokud je darován pouze jeden elektron, šipka bude mít na špičatém konci pouze „jednoho“ Barda.
v tomto případě je Lewisova kyselina boranem a Lewisova báze THF. Jak vidíte, báze darovala kyselině osamělý pár elektronů, aby vytvořila vazbu kyslík-Bor.
sloučeniny, které nejsou schopny tvořit addukty kvůli tvaru molekul, se nazývají frustrované Lewisovy páry.
Další čtení
http://www.chem.ucla.edu/~harding/IGOC/L/lewis_acid_base_adduct.html