VIVO Patofyziologie
Další Témata,
Aquaporiny: Vodní Kanály
Voda prochází přes buněčné membrány tím, že dvě trasy: difúze přes lipidovou dvojvrstvu a přes vodní kanály, tzv. aquaporiny. Funkční charakterizace první aquaporin byl zaznamenán v roce 1992, ale vodní kanály byly podezření na existenci dobře do té doby, protože osmotický propustnost některých typů epiteliálních buněk byl příliš velký, aby se tvořily prostou difúzí přes plazmatickou membránu.
jediný lidský aquaporin-1 kanál usnadňuje transport vody rychlostí zhruba 3 miliardy molekul vody za sekundu. Takový transport se zdá být obousměrný, v souladu s převládajícím osmotickým gradientem.
klasické aquaporiny transportu rozpuštěné látky-toaletní vody přes buněčné membrány; zdají se být exkluzivní vodních kanálů a ne projevit membrány pro ionty, nebo jiné malé molekuly. Některé aquaporiny-známé jako aquaglyceroporiny-transportují vodu plus glycerol a několik dalších malých molekul.
Aquaporin Rodiny
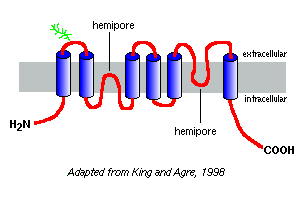
Více než 10 různých savců aquaporiny byly identifikovány k dnešnímu dni, a další členové jsou podezřelí existovat. Úzce související proteiny vodního kanálu byly izolovány z rostlin, hmyzu a bakterií. Aquaporin-1 z lidských červených krvinek byl první, který byl objeven a je pravděpodobně nejlépe studován.
Hydrofobicita pozemky jejich sekvencí aminokyselin předpovídají, že aquaporiny šest membránu překlenující segmenty, jak je znázorněno v modelu aquaporin-1 vpravo.
na základě studií s aquaporinem-1 se zdá, že aquaporiny existují v plazmatické membráně jako homotetramery. Každý monomer aquaporinu obsahuje dva hemi-póry, které se skládají dohromady a tvoří vodní kanál.
různé aquaporiny mají různé vzorce glykosylace. V případě aquaporinu-1 je peptidová páteř zhruba 28 kDa a glykosylované formy se pohybují od 40 do 60 kDa v hmotnosti. Většina aquaporiny mít protein kinázy A fosforylace motiv v jednom z cytoplazmatické smyčky, a diferenciální fosforylace je podezření empart regulační funkce do molekuly.
vzory exprese Aquaporinu
každý z aquaporinů má v podstatě jedinečný vzorec exprese mezi tkáněmi a během vývoje. Souhrn těchto vlastností, a některé z důležitých potenciálních nebo známých funkcí je uveden v následující tabulce:
| Hlavní Stránky Projevu | ||
|---|---|---|
| Aquaporin-0 | Oka: objektiv vlákna buňky | bilance Tekutin uvnitř objektivu |
| Aquaporin-1 | Červené krevní buňky | Osmotická ochrana |
| Ledvin: proximal tubule | Concentration of urine | Eye: ciliary epithelium | Production of aqueous humor | Brain: choriod plexus | Production of cerebrospinal fluid | Lung: alveolar epithelial cells | Alveolar hydration state |
| Aquaporin-2 | Kidney: collecting ducts | Mediates antidiuretic hormone activity |
| Aquaporin-3 * | Kidney: collecting ducts | Reabsorbtion of water into blood |
| Trachea: epitelové buňky | Sekreci vody do průdušnice | |
| Aquaporin-4 | Ledviny: sběrací kanálky | Reabsorbtion vody |
| Mozek: ependymal buněk | CSF rovnováhu tekutin | |
| Mozek: hypothalamus | Osmosensing funkce? | |
| Lung: bronchiální epitel | Bronchiální sekrece tekutiny | |
| Aquaporin-5 | Slinné žlázy | Produkce slin |
| Slzné žlázy | Produkce slz | |
| Aquaporin-6 | Ledviny | Velmi nízká propustnost vody; funkce? |
| Aquaporin-7 * | Tukové buňky | Transporty glycerolu z adipocytů |
| Varlat a spermií | ||
| Aquaporin-8 | Varlat, slinivky břišní, játra, ostatní | |
| Aquaporin-9 * | Leukocyty | |
| * aquaglyceroporin | ||
To by mělo být jasné, že aquaporiny jsou velmi široce rozšířeny, a také to, že různé aquaporiny mají různé funkčně-důležité specialit.
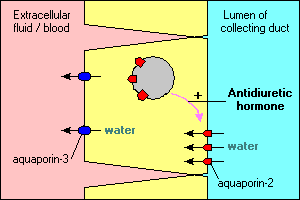
několik zajímavých a důležitých vlastností vodního transportu zprostředkovaného aquaporinem je ilustrováno v hlavních buňkách, které lemují sběrné kanály v ledvinách. Voda protékající těmito kanály může buď pokračovat a být vyprázdněna v moči, nebo může být reabsorbována přes epitel a zpět do krve. Reabsorpce je v podstatě nulová, pokud epiteliální buňky nevidí antidiuretický hormon, který silně stimuluje reabsorpci vody. Sběrné kanálové buňky exprimují nejméně dva aquaporiny:
- Aquaporin-2 je syntetizován, ale v nepřítomnosti antidiuretického hormonu se nachází v kaluži membránových váčků v cytoplazmě. Závazné antidiuretického hormonu na jeho receptor v buňce nejen stimuluje transkripci aquaporin-2 gen, ale způsobuje intracelulární pool aquaporin-2, aby být vložen do apikální membrány. Buňka je nyní schopna účinně přijímat vodu z lumenu kanálu.
- Aquaporin-3 je konstitutivně exprimován v bazolaterální membráně buňky. Když voda zaplaví do buňky kanály aquaporin-2, může rychle opustit buňku kanály aquaporin-3 a proudit do krve.
Aquaporiny a Nemoci
Vzhledem k tomu, že význam vodní dopravy v nesčetné množství fyziologických procesů, je třeba očekávat, že léze v aquaporin geny nebo získaná dysfunkce v aquaporiny může způsobit nebo přispět k několika chorobných stavů. Hledání takových spojení je stále brzy, ale byly identifikovány dva jasné příklady onemocnění vyplývající z nedostatku aquaporinů:
- mutace v genu aquaporin-2 způsobují u lidí dědičný nefrogenní diabetes insipidus.
- myši homozygotní pro inaktivační mutace v genu aquaporin-0 vyvinou vrozený katarakta.
- obezita u dospělých se vyvíjí u myší homozygotních pro inaktivaci mutací genu int he aquaporin-7, pravděpodobně kvůli neúčinnosti při transportu glycerolu z hydrolyzovaných triglyceridů.
malý počet lidí byl identifikován s těžkým nebo úplným nedostatkem aquaporinu-1. Je zajímavé, že se zdají klinicky neovlivněné, ale nebyly zkoumány za podmínek deprivace vody. Myši s cílenými delecemi v aquaporinu-1 se také zdají normální a zdravé, pokud nejsou omezeny tekutinou, v takovém případě se stanou vážně hyperosmolárními.
reference a recenze
- Borgnia M, Nielsen S, Engel A, Agre P: Buněčná a molekulární biologie vodních kanálů aquaporinu. Annu Rev Biochem 68: 425, 1999.
- deGroot BL, Grubmuller H: permeace vody přes biologické membrány: mechanismus a dynamika aquaporinu-1 a GlpF. Věda 294:2353, 2001.
- Hibuse T, Proc Nat Acad Sci (USA) 102: 10993, 2005.
- King LS, Agre P: patofyziologie vodních kanálů aquaporinu. Annu Rev Physiol 58: 619, 1998.
- Knepper MA, Inoue T: regulace vodního kanálu aquaporin-2 vazopresinem. Curr Opinion Cell Biol 9: 560, 1997.
- Lee MD, King LS, Agre P: rodina aquaporinů proteinů vodních kanálů v klinické medicíně. Medicína 76: 141, 1997.
- Preston GM, Carroll TP, Guggino WP Agre P: Výskyt vodních kanálů v oocytů Xenopus vyjádření red cell protein CHIP28. Věda 256: 385, 1992.
- Sasaki S, Ishibashi K, Marumo F: Aquaporin-2 a -3: Zástupci dvou podskupin aquaporin rodiny colocalized ve sběracím kanálku ledvin. Annu Rev Physiol 60: 199, 1998.