A Microbial Biorealm page on the genus Citrobacter freundii
Classification
Higher order taxa
Bacteria; Proteobacteria; Gammaproteobacteria; Enterobacteriales; Enterobacteriaceae; Citrobacter
Species
NCBI: Taxonomy
Citrobacter Freundii
Description and significance
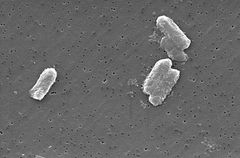 Photo: Pete Wardell / CDC
Photo: Pete Wardell / CDC
druhy Citrobacter, včetně Citrobacter freundii, jsou aerobní gramnegativní bacily. Citrobacter freundii jsou dlouhé tyčinkovité bakterie obvykle o délce 1-5 µm . Většina buněk C. freundii je obklopena mnoha bičíky používanými k pohybu, ale některé jsou nehybné. Jeho stanoviště zahrnuje životní prostředí (půda ,voda, Odpadní voda), jídlo a střevní trakt zvířat a lidí . Patří do čeledi Enterobacteriaceae.
jako oportunní patogen je C. freundii zodpovědný za řadu významných oportunních infekcí. Je známo, že je příčinou různých nozokomiálních infekcí dýchacích cest, močových cest, krve a několika dalších normálně sterilních míst u pacientů . C. freundii představuje přibližně 29% všech oportunních infekcí . Jedním z hlavních důvodů, proč se sekvenuje mnoho různých kmenů a plazmidů genomu C. freundii, je proto najít antibiotika, která mohou bojovat proti těmto oportunním infekcím.
překvapivě tento infekční mikrob u lidí hraje pozitivní roli v životním prostředí. C. freundii je zodpovědný za redukci dusičnanů na dusitany v životním prostředí . Tato zásadní přeměna je důležitou fází cyklu dusíku. A recyklace dusíku je velmi důležitá, protože zemská atmosféra je asi 85% dusíku . Proto je díky svému důležitému přínosu pro životní prostředí další motivací pro sekvenování genomu C.freundii.
Rod Citrobacter byl objeven v roce 1932 Werkmanem a Gillenem. Kultury C. freundii byly izolovány a identifikovány ve stejném roce z půdních extraktů .
struktura genomu
žádné informace o úplném genomu C. freundii nejsou k dispozici online, ačkoli některé jednotlivé kmeny a plazmidy mikrobu byly sekvenovány. Nejvýznamnější je plazmid pCTX-M#3, protože je největším plazmidem a kóduje velké množství proteinů. Jeho sekvence byla dokončena 6. ledna 2005. Je to Kruhový DNA plazmid a je dlouhý 89 468 párů nukleotidových bází. Délka plazmidu je 0,089468 (Mbp). Skládá se z 51,0% obsahu GC a kóduje 105 proteinů .
další důležitý rys C. freundii genom je, že je to jediný mikrob z čeledi Enterobacteriaceae, který obsahuje plazmid, který kóduje L-methionin γ-lyázu (MGL). Nukleotidová sekvence plazmidu obsahuje 3000 bp dlouhou EcoRI vložku . Fragment také obsahuje dva otevřené čtecí rámce. První snímek se skládá z 1,194 nukleotidů, a za druhé, 1,296 nukleotidů.První snímek, známý jako gen megL, kóduje protein 398 aminokyselinových zbytků, který má sekvenční homologii s MGLs z různých zdrojů. Druhý snímek kóduje protein se sekvenční homologií s proteiny patřícími do rodiny permeáz .
Gen C. freundii OS60 AmpC β-laktamázy byl také sekvenován a je složen z 1197 nukleotidů. Kóduje 380 aminokyselinový dlouhý prekurzor a obsahuje 19 zbytkový signální peptid na 5 ‚ konci. Tento gen kóduje zralý protein, který má molekulovou hmotnost 39 781 daltonů. Na pozicích aminokyselin v těchto prekurzorů jsou suprisinlgy identické zbytky v E. coli K12 chromozomální AmpC β-laktamázy .
další důležitý kmen v genomu C. freunii je GN346, což je klinický izolát získaný v roce 1965. Tento kmen produkuje enzym cefalosporinázu, který má schopnost hydrolyzovat a inaktivovat anibitoické cefalosporiny a cefamyciny . Strukturní a promotorové oblasti genu cefalosporinázy jsou dlouhé 1408 nukleotidů. Aminokyselinová sekvence zralého enzymu se skládá z 361 aminokyselin s molekulovou hmotností 39 878 Da .
buněčná struktura a metabolismus
buněčná struktura C. freundi je dlouhá a tyčovitá obvykle 1-5 µm na délku. Vnější strana buňky obsahuje mnoho bičíků používaných pro motalitu . Protože C. freundii je gramnegativní bakterie, obsahuje dvě membrány (vnitřní a vnější).Periplazmatický prostor leží mezi oběma membránami. Vnější membrána neobsahuje zdroj energie; ale obsahuje mnoho porinů vložených uvnitř, které pomáhají organismu získat důležité ionty . Na rozdíl od grampozitivních bakterií buňky C. freundii neobsahují silnou buněčnou stěnu tvořenou peptidoglykanem.
pro metabolismus má C. freundii úžasnou schopnost růst na glycerolu jako jediném zdroji uhlíku a energie. V tomto procesu je glycerol fermentován dismutačním procesem. Tento proces vyžaduje dvě cesty . V první cestě je glycerol dehydrogenován glyceroldehydrogenázou navázanou na nad1 na dihydroxyaceton. Dihydroxyaceton se pak fosforyluje a vede k glykolýze dihydroxyaceton kinázou . Ve druhé cestě je glycerol dehydratován glycerol dehydratázou závislou na koenzymu B12 za vzniku 3-hydroxypropionaldehydu . Tento produkt se redukuje na hlavní fermentační produkt 1,3-propandiol pomocí 1,3-propandiol dehydrogenázy navázané na NADH, která regeneruje NAD1. DHA regulon kóduje čtyři základní enzymy těchto dvou cest. Je úžasné, že exprese regulonu DHA je indukována pouze tehdy, když je přítomen glycerol .
buňky C. freundii jsou také schopné metabolizovat laktózu nebo citrát jako zdroj uhlíku .
ekologie
Citrobacter freundii se běžně vyskytují v životním prostředí, zejména v půdě, vodě a kanalizaci. Jsou indikátorem potenciální kontaminace vody. Nacházejí se také na různých orgánech nemocných zvířat, včetně savců, ptáků, plazů a obojživelníků . Není známo, že by interagovaly s jinými organismy.
v prostředí může C. freundii převést dusičnan nebo amonný iont (což je atom dusíku kombinovaný se čtyřmi atomy vodíku) na dusitan; tato reakce se vyskytuje v prostředí i v zažívacím traktu lidí a jiných zvířat . Poté převádí dusičnan na dusitan se v prostředí, dusitanů se přemění na dusík, a tento poslední krok dokončí koloběh dusíku v zemské atmosféře, která je tvořena z 85% dusíku . Ekologická role tohoto organismu zahrnuje nejen jeho důležitou roli v cyklu dusíku, protože může také akumulovat Uran (což je základní materiál pro jadernou technologii) budováním fosfátových komplexů .
Citrobacter freundii byl také zkoumán pro biodegradaci kyseliny tříslové používané v tannerys .
patologie
jako oportunní patogen je Citrobacter freundii často příčinou významných oportunních infekcí, což znamená, že obecně nezpůsobuje onemocnění u zdravých lidských hostitelů. Ovlivňují pouze pacienty se slabým imunitním systémem, což znamená, že potřebují „příležitost“ infikovat osobu . Proto je u pacientů s potlačeným imunitním systémem známo, že druhy Citrobacter způsobují širokou škálu nozokomiálních infekcí dýchacích cest, močových cest a krve . Onemocnění jater, žlučových cest a pankreatu jsou také běžná onemocnění způsobená C.freundii. Žlučový trakt je nejčastějším místem infekce bacily C .freundii.
jedním fatálním onemocněním, se kterým byl C. freundii spojován, je novorozenecká meningitida. Neonatální meningitida je zánět meningů (systém membrán, které obklopují CNS) v důsledku bakteriální invaze . Úmrtnost Citrobacter meningitidy je nepřijatelně vysoká, přičemž úmrtnost pacientů se pohybuje od 25 do 50 %. Závažné neurologické problémy navíc přetrvávají u 75% přeživších. U tohoto onemocnění je Citrobacter freundii schopen proniknout hematoencefalickou bariérou, která se skládá z epitelu choroidního plexu a endotelu kapilárního mozku .
testy prováděné Badgerem et. al v článku „Citrobacter freundii Napadá a množí se v Lidském Mozku Mikrovaskulárních Endoteliálních Buněk“naznačují, že šíření bakterií C. freundii se odehrává na intracelulární úrovni, které byly v rozporu s obecným vědeckého myšlení. Zjištění naznačují, že C. freundii prochází vakuoly, replikuje se a uvolňuje se do bazolaterální strany mikrovaskulárních endotelových buněk lidského mozku (HBMEC), aby překročil hematoencefalickou bariéru. Další analýza může potenciálně umožnit terapeutické strategie k léčbě infekcí. Stále není k dispozici žádná terapeutická léčba .
některé choroby studované u pstruhů a cyprinidů jsou také způsobeny C.freundii. C. freundii způsobuje abnormální zánětlivé změny ve střevě pstruhů a zánětlivé a nekrotické změny ve vnitřních orgánech kaprovitých ryb. Nemoc byla objevena pomocí umělé infekce čistou kulturou C.freundii. Tento objev založil C. freundii jako příčinu onemocnění ryb .
v případové studii časopisu Journal of Medical Microbiology se u pacienta vyvinula peritonitida a tunelová infekce způsobená Citrobacter freundii, což je méně časté. Pacient byl na kontinuální ambulantní peritoneální dialýze. Obvykle jsou příčinou grampozitivní mikroorganismy, zejména Staphylococcus aureus a Staphyloccus edpidermis. Také nejsou známy žádné zprávy o infekci tunelu v důsledku C. freundii. Počáteční antibiotická léčba nefungovala a infekce přetrvávala až do odstranění katétru. To je klinicky významné, protože Citrobacter Freundii vykazuje odlišnou citlivost na antibiotika, a proto počáteční léčba nebyla úspěšná. Pacient nereagoval na léčbu, dokud katetr byl odstraněn ukazuje Citrobacter freundii jsou oportunní patogeny, které ovlivňují hospitalizovaných a pacientů s oslabenou imunitou .
aplikace na biotechnologii
v biotechnologickém průmyslu produkuje Citrobacter freundii mnoho důležitých enzymů.První enzymy, které produkuje, je fosfatáza. Fosfatázová aktivita C. předpokládá se, že freundii se podílí na akumulaci olova, což může hrát důležitou roli v biotechnologickém průmyslu. Bylo také zjištěno, že aktivita fosfatázy C. freundii má rezistenci na některá diagnostická činidla .
čištění a charakterizace bakteriální selenocysteinu beta-lyázy, enzymu, který specificky katalyzuje štěpení L-selenocysteinu na L-alanin, byl očištěn od Citrobacter freundii. Enzym je monomerní s molekulovou hmotností ca. 64,000 a obsahuje 1 mol pyridoxal 5′-fosfát jako kofaktor na mol enzymu. Enzym také katalyzuje alfa, beta eliminaci beta-chlor-L-alaninu za vzniku NH3, pyruvátu .
kmeny C. Freundii také nesou plazmid, který kóduje cefalosporinázu AmpC třídy 1. Tyto enzymy mohou hydrolzye inaktivovat nové cefamyciny a cefalosporiny .
současný výzkum
malý výzkum týkající se některých kmenů C. freundii byl proveden nedávno na univerzitě v Tennessee v Knoxville. Význam určitých genů rezistence na tetracyklin a streptomycin a integronů třídy 1 v C. byly hodnoceny freundii izolované z půdy mléčných farem a nemléčných půd. Jeden kmen C. freundii extrahovaný z půd mléčných farem nesl integrony třídy 1 s různými vloženými genovými kazetami. Výsledky této malé studie naznačují, že přítomnost více genů rezistence a třídy 1 integrons v C. freundii v mléčné farmě půdy může působit jako zásobárna genů antimikrobiální rezistence a mohly by hrát roli v šíření těchto antimikrobiální rezistence geny do dalších komenzální a původních mikrobiálních společenstev v půdě. K podpoře této hypotézy jsou však zapotřebí další dlouhodobější studie prováděné na více místech .
druhý výzkum v podobně C. freundii bylo děláno s cílem navrhnout polymerázové řetězové reakce (PCR) metoda, která současně používá tři páry specifických primerů pro detekci genů některých mikrobů (včetně C. freundii). Metoda zahrnuta projekční tři páry primerů, které byly: SPVC-1 a SPVC-2, INVA-1 a INVA-2; a VIAB-1 a VIAB-2. PCR byla provedena pomocí těchto tří primerů k identifikaci 14 klinicky důležitých bakteriálních organismů. Tyto kmeny byly rychle identifikovány pomocí PCR: (1) C. freundii; (2) S. Typhi, a. S. Paratyphi C; (3) S. Dublin (virulence antigen-pozitivní); a (4) sérovary Salmonel, že přístav spv-typ virulenci plazmidu. Ačkoli je tato metoda PCR Nová, s pokrokem technologie v budoucnu může tato metoda umožnit okamžitou identifikaci C. freundii u savců, takže lze neprodleně zahájit vhodnou léčbu antibiotiky .
třetí studie koncertu C. freundii byla provedena na univerzitě v Barceloně ve Španělsku. Byly studovány mechanismy rezistence na fluorochinolony ve dvou kmenech Citrobacter freundii. Oba kmeny byly izolovány od stejného pacienta. Tato studie umožnila částečnou charakterizaci genů acrA a acrB tohoto mikroorganismu. Exprese genů v obou kmenech byla analyzována pomocí DNA mikroarrays pro Escherichia coli. Podobnost nukleotidů mezi částečně sekvenovanými geny acrA a acrB C. freundii a E. coli byla 80,7% a 85%. Geny acrA a acrB C. freundii jsou podobné genům v e. coli a jejich nadměrná exprese mohou hrát důležitou roli při modulaci konečné minimální inhibiční koncentrace fluorochinolonů .
čtvrtá studie týkající se C. freundii byla provedena na Tchaj-wanu. Tým vědců izoloval diabetického pacienta, u kterého se vyvinula nekrotizující fasciitida způsobená C. freundii z poranění vyvolaného mořským zvířetem. Nekrotizující fasciitida je infekce v hlubší vrstvě kůže a podkožních tkání. Při léčbě pacienta odebrali vzorek z tekutiny v ráně a našli C.freundii. Po třech dnech od zahájení antibiotické léčby cefotaxminem a cefepminem došlo k akumulaci subkutánních abscesů. Po 6, 10, 14 a 21 dnech péče o pacienta dávala některá antibiotika pacientovi určitou úlevu, ale nebylo dosaženo dlouhodobého zotavení. Cefotoaxim, cefepim, ciprofloxamin patří mezi antibiotika, která se neshodují s C.freundii. Pacient se plně zotavil po 42 dnech léčby ertapenemem. Vědci izolovali dvě kolonie C. freundii do 5 dnů od sebe. Jak byly izoláty pěstovány, staly se nesmírně rezistentními na cefotaxim a cefepim. Důvod, proč entrapenem působil proti C. freundii, je ten, že je účinný proti AmpC produkujícím Enterobacteriaceae .
rezistence na antibiotika
druhy Citrobacter jsou častou příčinou nozokomiálních infekcí spojených s pacienty, kteří podstupují dlouhodobou nemocniční léčbu. Nedávno bylo hlášeno, že C. freundii vyjadřuje rezistenci na širokospektrální antibiotika včetně piperacilinu, piperacillintazobaktamu, vankomycinu a cefalosporinů. Izolace ceftriaxon-odolné Citrobacter freundii (CRCF) byla spojena s overprescribed širokospektrých antibiotik. Vznikající nové kmeny CRCF by mohly naznačovat indukci nebo depresi genů rezistence a eliminaci konkurenčních organismů. CRCF byl většinou izolován od pacientů s významnými komorbiditami včetně AIDS, onemocnění periferních cév a cerebrovaskulárních onemocnění. Bylo také hlášeno, že použití fluorochinolonu nemá žádný vliv na izolaci CRCF .
Je také známo, že Citrobacter freundii obsahuje ve svém chromozomu gen kódující cefalosporinázu. Tento enzym hydrolyzuje −CO−NH− bond v laktamu cefalosporinů a cephamycis což činí bakterie rezistentní na tento typ antibiotik. Nicméně, když jsou vystaveny nové třetí generace cephems a cerbapenems, klinicky izolován C. freundii ukázala citlivost na tyto látky.Na chirurgickém oddělení Fakultní nemocnice Nagoya u pacientů, kteří podstoupili chirurgické zákroky, bylo pozorováno malé ohnisko C. freundii rezistentní na cephems třetí generace. C.freundii byl izolován z žluči pacienta, gázy rány, výkalů, hnisu a ascitu. To bylo navrhl, že tyto nové kmenů C. freundii obsahovaly plazmid kódování AmpC celphalosporinase ale při selhání přenosu cephems odpor od C. freundii E. coli bylo zjištěno, že enzym musí být kódovány na chromozomu C. freundii. Od C. freundi je spojena s nozokomiální infekce upozornění na tuto novou kmenů je doporučeno .
1. Wang JT, Chang SC, Chen YC, Luh KT. „Srovnání antimikrobiální citlivosti izolátů Citrobacter freundii ve dvou různých časových obdobích.“Journal of Microbiology, Immunology and Infection. 2000 Prosinec; 33 (4): 258-62.
2. Whalen JG, Mully TW, Enlgish JC 3. „Spontánní infekce Citrobacter freundii u imunokompetentního pacienta.“Archiv dermatologie. 2007 Leden; 143 (1): 124-5.
3. Pučenkova SG. „Enterobakterie v oblastech vody podél krymského pobřeží.“Mikrobiolohichny zh zhurnal. 1996 Březen-Duben; 58 (2): 3-7.
4.http://www.ncbi.nlm.nih.gov/sites/entrez?db=genomeprj&cmd=Retrieve&dopt=Overview&list_uids=13123
5. Ilya V. Manukhov, Daria V. Mamaeva, Sergej V. Rastorguev, Nicolai G.Faleev, Elena a. Morozova, Tatyana v. Demidkina a Gennadii B. Zavilgelsky. „Gen Kódující L-Methionin γ-Lyázy Je Přítomen v Enterobacteriaceae Rodiny Genomy: Identifikace a Charakterizace Citrobacter freundii L-Methionin γ-Lyázy.“Žurnál Bakteriologie. 2005 červen; 187 (11): 3889-3893.
6. Lindberg, Frederik, Westman, Lennart, Normark, Staffan. „Regulační složky v indukci Citrobacter freundii ampC β-laktamázy.“Sborník Národní akademie věd Spojených států amerických. 1985 Červenec; 82 (14): 4620-4624.
7. Tsukamoto K, Tachibana K., Yamazaki N, Ishii Y, Udžije K, Nishida N, Sawai T. „Role lysinu-67 v aktivním místě třídy C beta-laktamázy z Citrobacter freundii GN346.“European Journal of Biochemistry/FEBS. 1990 Února 22; 188 (1): 15-22.
8. Keevil CW, Hough JS, Cole JA. „Prototypický růst Citrobacter freundii a biochemický základ pro jeho zjevné požadavky na růst v provzdušněných médiích.“Journal of General Microbiology. 1997 Jan; 98 (1): 273-6.
9. Marco Sánchez F, Turabian Fernández JL, Durán Pérez-Navarro a. „Fatální Citrobacter Freundii bronchopneumonie získané v komunitě u nekompromisního pacienta.“Revista Clínica Española. 1985 Apr; 176 (6): 320
10. Julie L. Badger, Monique F. Stins, a Kwang Sik Kim. „Citrobacter freundii napadá a replikuje se v mikrovaskulárních endotelových buňkách lidského mozku.“Hinyokika kiyo. Acta Urologica Japonica. 1985 července; 31 (7): 1159-70.
11. Drelichman V, kapela JD. „Bakterémie způsobené Citrobacter diversus a Citrobacter freundii. Incidence, rizikové faktory a klinický výsledek.“Archiv vnitřního lékařství. 1985 Říjen; 145 (10): 1808-10.
12. Srinivasan V, Nam HM, Sawant AA, Headrick SI, Nguyen LT, Oliver SP. „Distribuce genů rezistence na tetracyklin a Streptomycin a Integronů třídy 1 v Enterobacteriaceae izolovaných z mléčné a nemléčné zemědělské půdy.“Mikrobiální Ekologie. 2007 15. Srpna.
13. Sánchez-Céspedes J, Vila J. „Částečná charakterizace acrAB locus ve dvou Citrobacter freundii klinických izolátů.“International Journal of Antimikrobial Agents. 2007 Září; 30 (3): 259-63.
14. Ciğerci IH, Korcan SE, Konuk M, Oztürk s. „Porovnání Alad aktivit kmenů Citrobacter a Pseudomonas a jejich využití jako biomarkeru pro kontaminaci Pb.“Monitorování a hodnocení životního prostředí. 2007 22.května.
15. Chocat P, Esaki N, Tanizawa K, Nakamura K, Tanaka H, Soda k. “ čištění a charakterizace selenocystein beta-lyázy od Citrobacter freundii.“Journal of Bakteriologie. 1985 Srpen; 163 (2): 669-76.
16. Hillel S Levinson, Inga Mahler. „Aktivita fosfatázy a rezistence na olovo u Citrobacter freundii a Staphylococcus aureus.“FEMS Microbiology Letters. 1998 dubna; 161 (1): 135-138.
17. Murakami K, Yoshida T. „kovalentní vazba moxalaktamu na cefalosporinázu Citrobacter freundii.“Antimikrobiální látky a chemoterapie. 1985 Květen; 27 (5): 727-32.
18. Dervisoglu, e., Yegenaga, i., Yumuk, z. “ Citrobacter Freundii peritonitida a infekce tunelu u pacienta na kontinuální ambulantní peritoneální dialýze.“Journal of Medical Microbiology, 2008. Svazek 57. s. 125-127.
19. Kim PW, Harris AD, Roghmann MC, Morris JG Jr, Strinivasan A, Perencevich EN. „Epidemiologické rizikové faktory pro izolaci ceftriaxon-odolné proti náchylné citrobacter freundii u hospitalizovaných pacientů“ Antimicrob Agents Chemother, 2003 Sep;47(9): p.2882-2887.
20. Nada T, Baba H, Kawamura K, Ohkura T, Torii K, Ohta M. „malé vypuknutí třetí generace cefem odolné Citrobacter freundii infekcí na chirurgickém oddělení“ Jpn J Infikovat Dis. 2004 Aug; 57 (4): s. 181-182.
21. Chuang, y., Tseng, s., Teng, l., Ho, Y., and Hsueh, P. „Vznik rezistence cefotaximu u Citrobactor freundii způsobující nekrotizující fasciitidu a osteomyelitidu“ Journal of Infection, 2006. Svazek 53. s. e161-e163.
22.Jezevec, J., Stins, M., a Sik Kim, K. „Citrobacter freundii Napadá a množí se v Lidském Mozku Mikrovaskulární Endoteliální Buňky“ Infekce a Imunita, 1999. Volume67. P. 4208-4215.
Editoval Sumaira Akbarzada, studentka Rachel LarsenEdited Greg Vargas a Darren Zhen ,studenti M Glogowskiat Loyola UniversityEdited o Gergana Grigorova a Michal Olszewski, studenti M Glogowskiat Loyola UniversityEdited Alex Kula a Joanna Aiken, studenti M Glogowskiat Loyola University