Generic Name: epinastine hydrochloride
Dosage Form: ophthalmic solution
Medically reviewed by Drugs.com. Last updated on June 1, 2020.
- Overview
- Side Effects
- Dosage
- Professional
- Pregnancy
- More
Indications and Usage for Epinastine HCl Ophthalmic Solution
Epinastine HCl Ophthalmic Solution 0.05% je indikováno k prevenci svědění spojeného s alergickou konjunktivitidou.
Epinastine HCl oční roztok dávkování a podání
doporučená dávka je jedna kapka do každého oka dvakrát denně.
Léčba by měla pokračovat po dobu expozice (tj. dokud pylová sezóna je u konce, nebo do vystavení problematický alergen je ukončeno), i když příznaky nejsou přítomny.
lékové formy a síly
roztok obsahující 0.5 mg/mL epinastine HCl
Kontraindikace
None
Upozornění a Opatření
Kontaminace Tip a Řešení
Pacienti by měli být poučeni, aby se zabránilo umožňuje špička dávkovací nádoby kontaktovat oka, okolních struktur, prsty, nebo jiný povrch, aby se zabránilo kontaminaci roztoku běžných bakterií známo, že způsobují oční infekce. Při použití kontaminovaných roztoků může dojít k vážnému poškození oka a následné ztrátě zraku.
lahvička by měla být uchovávána těsně uzavřená, pokud se nepoužívá.
použití s kontaktními čočkami
pacienti by měli být poučeni, aby nenosili kontaktní čočku, pokud je jejich oko červené. Epinastine HCl Oční Roztok 0.05% by neměl být používán k léčbě kontaktní čočky-související podráždění.
konzervační látka v očním roztoku Epinastinu HCl 0,05%, benzalkoniumchlorid, může být absorbována měkkými kontaktními čočkami. Kontaktní čočky by měly být odstraněny před instilací očního roztoku Epinastine HCl 0,05% a mohou být znovu vloženy po 10 minutách po podání.
pouze lokální Oční podání
Epinastin HCl oční roztok 0.05% je určeno pouze k lokálnímu očnímu podání, nikoli k injekci nebo perorálnímu podání.
Nežádoucí Účinky
Klinické Studie Zkušenosti
Protože klinické studie prováděny za velmi různých podmínek, aby negativní reakční rychlosti pozorované v klinických studiích lék nelze přímo srovnávat s sazeb v klinických studiích jiný lék, a nemusí odrážet ceny zjištěné v praxi.
nejčastěji hlášenými očními nežádoucími účinky, které se vyskytly přibližně u 1 až 10% pacientů, byly pocit pálení v oku, folikul, hyperemie a svědění.
nejčastěji hlášenými non-oční nežádoucí účinky byly infekce (nachlazení a infekce horních cest dýchacích), viděn v přibližně 10% pacientů, a bolest hlavy, rýma, zánět vedlejších nosních dutin, zvýšený kašel, zánět hltanu, viděn v cca 1 – 3% pacientů.
některé z těchto reakcí byly podobné studovanému základnímu onemocnění.
postmarketingové zkušenosti
následující reakce byly zjištěny během postmarketingového použití očního roztoku Epinastinu HCl 0,05% v klinické praxi. Vzhledem k tomu, že jsou hlášeny dobrovolně z populace neznámé velikosti, nelze provést odhady frekvence. Reakce, které byly vybrány pro zařazení vzhledem k jejich závažnosti, četnosti podávání zpráv, možné příčinné souvislosti se Epinastine HCl Oční Roztok 0.05%, nebo kombinace těchto faktorů, patří: zvýšené slzení.
POUŽITÍ V KONKRÉTNÍ POPULACI
Těhotenství
Teratogenní Účinky,
Těhotenství Kategorie C,
V embryofetální vývojové studii u březích potkaních samic, mateřské toxicity s žádné embryofetální účinky bylo pozorováno po podání perorální dávky, která byla přibližně 150.000 krát maximální doporučená oční dávka pro člověka (MROHD) 0.0014 mg/kg/den mg/kg. Celková resorpce a potratů byly pozorovány v embryofetální studie u březích samic králíků při perorálním podání dávky, která byla přibližně 55 000 krát MROHD. V obou studiích nebyly zaznamenány žádné teratogenní účinky vyvolané léčivem.
Epinastine snížena pup tělesné hmotnosti po perorálním podání březím samicím potkana, který byl přibližně 90 000 krát MROHD.
neexistují však žádné adekvátní a dobře kontrolované studie u těhotných žen. Protože reprodukční studie na zvířatech nejsou vždy prediktivní pro lidská reakce, Epinastine HCl Oční Roztok 0.05% by měl být používán během těhotenství pouze, pokud potenciální přínos ospravedlňuje potenciální riziko pro plod.
kojící matky
studie u laktujících potkanů odhalila vylučování epinastinu do mateřského mléka. Není známo, zda se tento lék vylučuje do mateřského mléka. Protože mnoho léků se vylučuje do lidského mateřského mléka, je třeba opatrnosti při Epinastine HCl Oční Roztok 0,05% je podáván kojícím ženám.
pediatrické použití
bezpečnost a účinnost u dětských pacientů mladších 2 let nebyla stanovena.
geriatrické použití
u starších a mladších pacientů nebyly pozorovány žádné celkové rozdíly v bezpečnosti nebo účinnosti.
popis očního roztoku Epinastinu HCl
oční roztok Epinastinu HCL 0.05% is a clear, colorless, sterile isotonic solution containing epinastine HCl, an antihistamine and an inhibitor of histamine release from the mast cell for topical administration to the eyes.
Epinastine HCl is represented by the following structural formula:
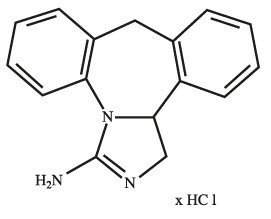
C16H15N3HCl Mol. Wt. 285.78
Chemical Name:
3-Amino-9,13b-dihydro-1H-dibenzimidazoazepine hydrochloride
Each mL contains: Active: Epinastine HCl 0.05% (0.5 mg/mL) equivalent to epinastine 0.044% (0.44 mg/mL); Preservative: Benzalkonium chloride 0.01%; Inactives: Edetát disodný, dihydrát; čištěná voda; chlorid sodný; fosforečnan sodný, monobazický, bezvodý; a hydroxid sodný a / nebo kyselina chlorovodíková(pro úpravu pH).
Epinastin HCL oční roztok 0,05% má pH přibližně 7 a osmolalitu v rozmezí 250 až 310 mOsm/kg.
Epinastine HCl Oční Roztok – Klinická Farmakologie
Mechanismus účinku
Epinastine je lokálně aktivní, přímá H1-receptorů a inhibitor uvolňování histaminu z žírných buněk. Epinastin je selektivní pro histaminový H1-receptor a má afinitu k histaminovému H2-receptoru. Epinastin má také afinitu k receptorům α1, α2 a 5-HT2.
Farmakokinetika
Čtrnáct subjektů, alergický zánět spojivek, dostal jednu kapku Epinastine HCl Oční Roztok 0.05% do každého oka dvakrát denně po dobu 7 dnů. 7. den byly průměrné maximální plazmatické koncentrace epinastinu 0,04±0,014 ng / ml dosaženy přibližně po dvou hodinách, což svědčí o nízké systémové expozici. Zatímco tyto koncentrace představuje nárůst oproti těm, které byly pozorovány po jednorázové dávce, v den 1 a den 7 Plochy Pod Křivkou (AUC) byly hodnoty beze změny, což naznačuje, že tam je žádné zvýšení systémové absorpce s více dávkování. Epinastin se ze 64% váže na plazmatické proteiny. Celková systémová clearance je přibližně 56 L / hod a terminální Plazmatický eliminační poločas je přibližně 12 hodin. Epinastin se vylučuje hlavně v nezměněné podobě. Přibližně 55% intravenózní dávky je získáno v nezměněné formě v moči, přibližně 30% ve stolici. Méně než 10% je metabolizováno. Renální eliminace probíhá hlavně aktivní tubulární sekrecí.
Neklinické Toxikologické
Karcinogeneze, Mutageneze, Poškození Fertility
V 18-měsíc nebo 2-leté dietní studie kancerogenity u myší nebo potkanů, respektive, epinastine nebyl karcinogenní v dávkách až do 40 mg/kg .
Epinastin v nově syntetizovaných šaržích byl negativní na mutagenitu v testu Ames/Salmonella a in vitro testu chromozomální aberace pomocí lidských lymfocytů. Pozitivní výsledky byly pozorovány u časných šarží epinastinu ve dvou studiích in vitro chromozomální aberace provedených v 80. letech s lidskými periferními lymfocyty a s buňkami V79. Epinastin byl negativní ve studiích klastogenity in vivo, včetně mikronukleárního testu na myších a chromozomové aberace u čínských křečků. Epinastin byl také negativní v testu buněčné transformace pomocí embryonálních buněk syrského křečka, V79 / HGPRT testu bodové mutace savčích buněk a in vivo/in vitro testu neplánované syntézy DNA pomocí primárních hepatocytů potkanů.
Epinastin neměl žádný vliv na fertilitu samců potkanů. Snížená Fertilita u samic potkanů byla pozorována při perorální dávce až přibližně 90 000krát vyšší než je MROHD.
Klinické Studie
Epinastine HCl 0.05% byla prokázána významně lepší vozidlo na zlepšení oční svědění u pacientů s alergickou spojivek v klinických studiích s použitím dvou různých modelů: (1) spojivkového antigen challenge (CAC), kde byli pacienti dávkovat a pak dostal antigen vštípil do nižší spojivkového fornixu; a (2) terénní studie v oblasti životního prostředí, kde byli pacienti dávkováni a hodnoceni během období alergie v jejich přirozeném prostředí. Výsledky ukázaly rychlý nástup účinku pro epinastine HCl 0.05% během 3 až 5 minut po spojivkového antigen challenge. Ukázalo se, že doba trvání účinku je 8 hodin, takže je vhodný režim dvakrát denně. Ukázalo se, že tento dávkovací režim je Bezpečný a účinný po dobu až 8 týdnů bez známek tachyfylaxe.
jak se dodává / skladování a manipulace
Epinastine HCl oční roztok 0.05% je dodáváno sterilní v bílé neprůhledné LDPE plastových lahvích s kapátkem tipy a bílého polypropylenu (PP), čepice, takto:
| 5 mL v 10 mL láhev | NDC 51991-836-75 |
Skladování: Skladujte při teplotě 20° – 25°C (68° – 77°F) . Uchovávejte lahvičku těsně uzavřenou a mimo dosah dětí.
Pacient Poradenství Informace
Sterilita Dropper Tip
Pacienti by měli být poučeni, abyste se nedotkli kapátkem tip na jakýkoli povrch, protože to může kontaminovat obsah (viz UPOZORNĚNÍ A OPATŘENÍ, 5.1).
současné používání kontaktních čoček
pacienti by měli být poučeni, aby nenosili kontaktní čočky, pokud jsou jejich oči červené. Pacienti by měli být poučeni, že Epinastine HCl Oční Roztok 0.05% by neměl být používán k léčbě kontaktní čočky-související podráždění. Pacienti by měli být rovněž doporučuje, aby odstranit kontaktní čočky před instilací Epinastine HCl Oční Roztok 0.05%.
konzervační látka v očním roztoku Epinastinu HCl 0,05%, benzalkoniumchlorid, může být absorbována měkkými kontaktními čočkami. Čočky mohou být zařazeny po 10 minutách po podání Epinastine HCl Oční Roztok 0.05%
Lokální Oční Použít Pouze
Pro lokální oční podání.
Rx only
distribuováno společností:
Breckenridge Pharmaceutical, Inc.
Berlin, CT 06037
výrobce:
PrimaPharma, Inc.
San Diego, CA 92121
Rev: 04/2020
2323 04/20
PRINCIPAL DISPLAY PANEL – 5 mL Bottle Carton
NDC 51991-836-75
Epinastine HCl
Ophthalmic
Solution,
0.05%
FOR USE IN THE
EYES ONLY
sterile
Rx Only
5 mL sterile
breckenridge
A Towa
Company

| EPINASTINE HYDROCHLORIDE epinastine hydrochloride solution/ drops |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Labeler – Breckenridge Pharmaceutical, Inc. (150554335)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| PrimaPharma, Inc. | 079699106 | MANUFACTURE(51991-836) | |
Více o epinastine oční
- Nežádoucí Účinky
- Během Těhotenství nebo Kojení
- Dávkování Informací
- Ceny & Kupóny
- V češtině
- 3 Recenze
- třídy Drog: oční antihistaminika a dekongestanty
Spotřebitelské zdroje
- Informace pro Pacienta
- Epinastine Oční (Pokročilé Čtení)
Odborné zdroje
- Předepisování Informace
- Epinastine (Profesionální Pacient Poradenství)
Jiných značek Elestat
Související léčba vodítka
- zánět Spojivek, Alergické
Medical Disclaimer