Identifikujte Nejkyselší h molekuly
metodický přístup funguje nejlépe. Jednoduše řečeno, musíte skenovat molekulu pro kyselé funkční skupiny a poté zařadit reaktivitu těchto skupin. Nejvíce kyselá funkční skupina obvykle drží nejvíce kyselé H v celé molekule.
„skenování a hodnocení“ zní jednoduše, ale skrývá několik obtíží, které jsou popsány níže.
skenování molekuly pro známé kyselé funkční skupiny
kyselé protony jsou obvykle vázány na O nebo N. Proto je prvním krokem hledat všechny vazby OH a NH.
Nicméně, jak si najít OH a NH dluhopisů, budete muset rozhodnout, zda tyto vázané atomy by měly být soustředěné do funkční skupiny se sousedními atomy.
jedinou vhodnou metodou pro identifikaci funkční skupiny je již znát některé. Pokud například víte, že ROH, RCO2H a RSO3H jsou běžné kyselé funkční skupiny, nebudete mít problém najít kyselé skupiny v následující molekule (správné skupiny jsou označeny červeně).
Rank OH a NH kyselost odděleně.
hodnoty pKa společného OH a NH kyselin span široké rozsahy a jejich rozsahy překrývají. Pořadí probíhá rychleji, pokud řadíte kyseliny OH a NH samostatně, a poté porovnejte nejlepší kandidáty v každé kategorii.
nejvhodnější metodou pro hodnocení kyselých skupin je již znát jejich charakteristické hodnoty pKa. Pokud znáte tyto hodnoty pro všechny kyselé skupiny ve vaší molekule, pak skupina s nejnižším pKa obsahuje nejvíce kyselé h.případ uzavřen.
Pokud si nepamatujete hodnoty pKa pro všechny kyselé skupiny, může vás vést několik obecných zásad.
# 1 Význam-kladně nabité kyseliny jsou silnější než neutrální kyseliny. Záporně nabité kyseliny jsou zřídka kyselé. Pokud porovnáte hodnoty pKa společného AHA kyselin, uvidíte, že ROH2+ kyselin (které zahrnuje H3O+ a R2OH+) jsou podstatně silnější než neutrální kyseliny, jako RCO2H, PhOH, a ROH. Jediný neutrální kyselin, které jsou silnější než ROH2+ jsou H2SO4 a některé další RSO3H.
formální náboj pravidlo platí ještě silněji NH kyselin. Rozdíl v pKa mezi H3O+ a H2O je 18 jednotek, zatímco rozdíl v pKa mezi NH4+ a NH3 je gigantických 26 jednotek.
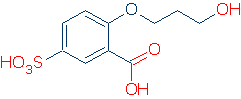
#2 Význam – podívejte se na aktivaci skupin, včetně RSO2, RC=O, a Ph. následující graf ukazuje, jak jednotlivé skupiny atomů aktivuje OH kyselina (pKa hodnoty v rozmezí od 16 až -2):
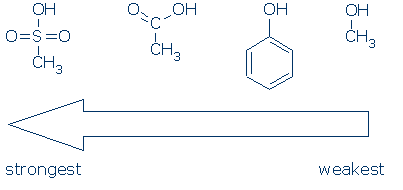
CH3 je považován za divácké skupiny, všude, kde se objeví v těchto molekul. Je nepolární a nevykazuje významný polní induktivní účinek a není schopen delokalizovat náboj. V důsledku toho je možné nahradit CH3 jinými diváckými skupinami (například H a jinými R), aniž by to ovlivnilo reaktivitu.
je třeba uvést dva další body týkající se aktivace skupin.
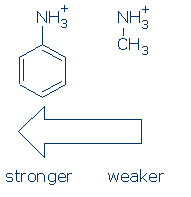
za Prvé, skupiny vyvíjet podobný účinek na NH kyselin (a aktivační sekvence je stejný: RSO2 > RC=O > Ph). Jak se to stane, stačí se naučit vliv Ph na NH + pro tento kurz:
za Druhé, aktivace skupiny musí být vázané přímo na OH (nebo NH) skupiny s cílem aktivovat. Tyto sloučeniny mají podobné hodnoty pKa, protože aktivace skupiny nejsou vázány přímo na OH: CH3C(=O)CH2OH, PhCH2OH, a CH3CH2OH.
#3 význam-všechny věci jsou stejné, kyselina OH je kyselejší než kyselina NH. Tento princip může být velmi užitečný, pokud je používán správně. Mým zájmem je, abyste pochopili, co se rozumí pod pojmem “ všechny věci jsou si rovny.“To znamená, že O A N musí mít stejný formální náboj (položka #1) a musí být spojeny se stejnou aktivační skupinou (položka #2). Rozdíly v diváckých skupinách však nezáleží.
Některé platné srovnání patří:
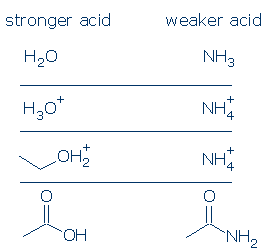
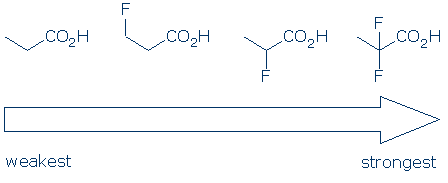
#4 Význam – v rámci funkční skupiny kategorie, použijte substituent účinky porovnat kyselin. Elektronegativní substituenty obvykle zvyšují kyselost funkční skupiny kombinací polních a indukčních účinků. Tyto účinky jsou zesíleny, když 1) substituent je umístěn blíže k kyselé skupině a 2) Existuje více substituentů. Vzhledem k těmto principům očekáváme, že kyselost těchto karboxylových kyselin bude následovat tento trend: