dipoler
for at forstå arten af ikke-kovalente interaktioner skal vi først vende tilbage til kovalente bindinger og dykke ned i emnet dipoler. Mange af de kovalente bindinger, som vi har set – mellem to carbonatomer, for eksempel eller mellem et carbon og et hydrogen –involverer den omtrent lige store deling af elektroner mellem de to atomer i bindingen. I disse eksempler har de to atomer omtrent den samme elektronegativitet. Husk fra dit generelle kemikursus, at elektronegativitet henviser til” kraften i et atom i et molekyle til at tiltrække elektroner til sig selv ” (dette er definitionen, der tilbydes af Linus Pauling, den fremtrædende amerikanske kemiker fra det 20.århundrede, der primært var ansvarlig for at udvikle mange af de bindingskoncepter, som vi har lært).
imidlertid beskæftiger vi os ganske ofte i organisk kemi med kovalente bindinger mellem to atomer med forskellige elektronegativiteter, og i disse tilfælde er delingen af elektroner ikke ens: den mere elektronegative kerne trækker de to elektroner tættere på. I kulstof-iltbindingen af en alkohol holdes for eksempel de to elektroner i sigma-bindingen tættere på iltet, end de er til kulstoffet, fordi ilt er signifikant mere elektronegativt end kulstof. Det samme gælder for ilt-hydrogenbindingen, da brint er lidt mindre elektronegativt end kulstof og meget mindre elektronegativt end ilt.
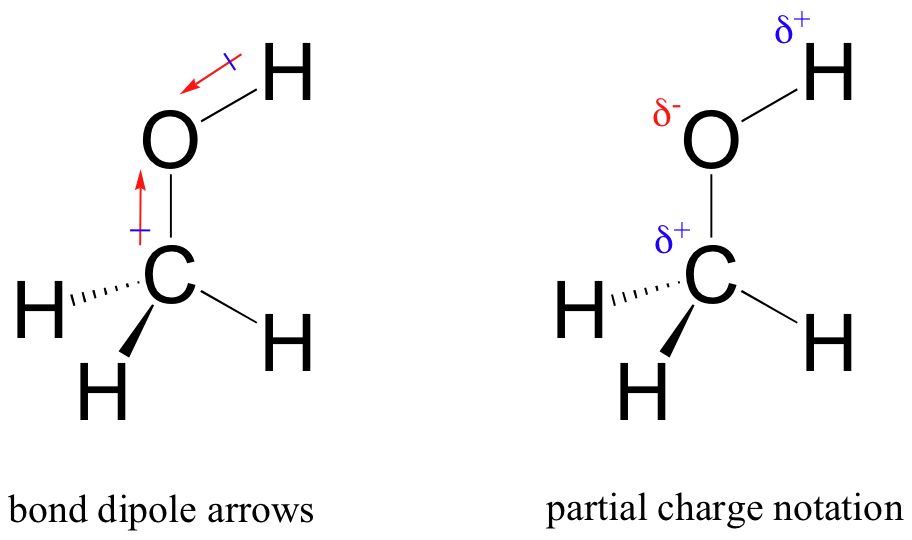
resultatet af denne ulige deling er det, vi kalder en bindingsdipol, som findes i en polær kovalent binding. En bindingsdipol har både negative og positive ender eller poler, hvor elektrondensiteten er lavere (den positive pol) og højere (den negative pol). Forskellen i elektrondensitet kan udtrykkes ved hjælp af det græske bogstav delta at betegne ‘delvis positiv’ og ‘delvis negativ’ ladning på atomerne. ‘Dipolpile’ med et positivt tegn på halen bruges også til at angive dipolens negative (højere elektrondensitet) retning.
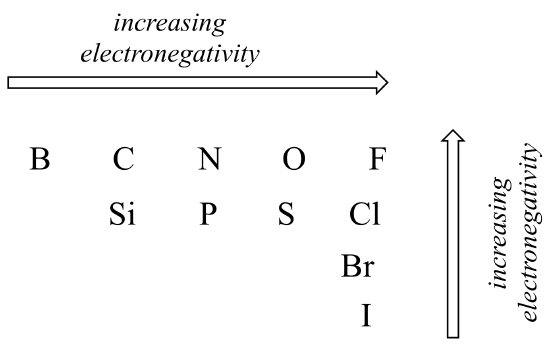
graden af polaritet i en kovalent binding afhænger af forskellen i elektronegativitet mellem de to atomer. Elektronegativitet er en periodisk tendens: den øges fra venstre mod højre over en række af elementernes periodiske tabel og øges også, når vi bevæger os op ad en kolonne. Derfor er ilt mere elektronegativt end nitrogen, hvilket igen er mere elektronegativt end kulstof. Ilt er også mere elektronegativt end svovl. Fluor, i øverste højre hjørne af det periodiske system, er den mest elektronegative af elementerne. Brint er lidt mindre elektronegativt end kulstof.
periodiske tendenser i elektronegativitet
øvelse 2.26
brug hvad du om atomorbitaler, rationalisere de periodiske tendenser i elektronegativitet. Hvorfor stiger det fra venstre mod højre og falder fra top til bund? Dette er et godt spørgsmål at tale igennem med klassekammerater og en instruktør eller vejleder.
løsninger til øvelser
de fleste molekyler indeholder både polære og ikke-polære kovalente bindinger. Afhængig af placeringen af polære bindinger og bindingsgeometri kan molekyler have en nettopolaritet, kaldet et molekylært dipolmoment. Vand, som du sandsynligvis husker, har et dipolmoment, der skyldes de kombinerede dipoler af dets to ilt-hydrogenbindinger. Fluormethan har også et dipolmoment.
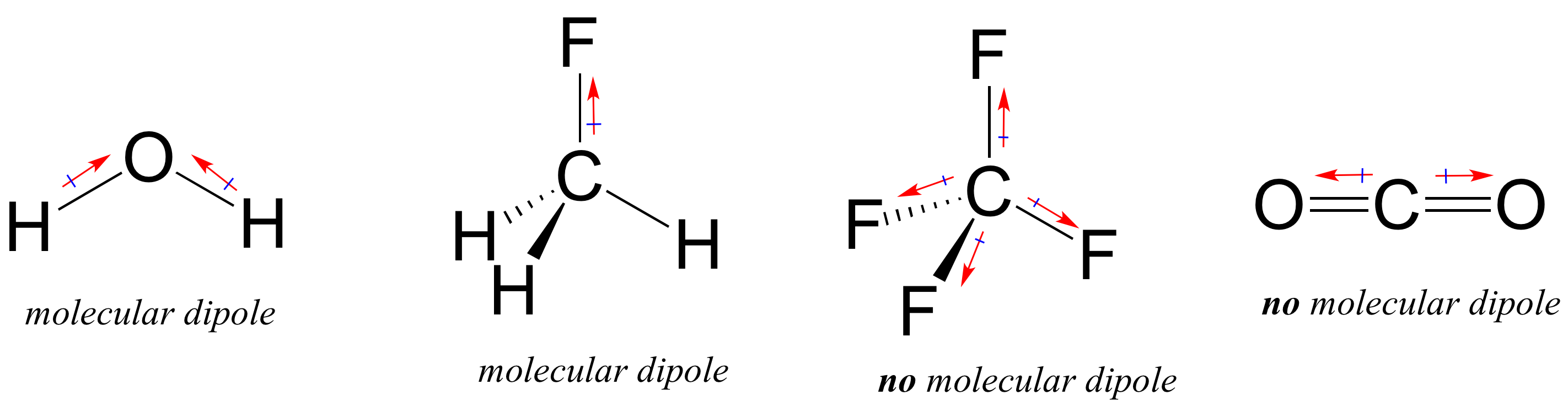
Tetrafluormethan har dog fire polære bindinger, der trækker lige ind i de fire hjørner af en tetahedron, hvilket betyder, at selvom der er fire bindingsdipoler, er der intet samlet molekylært dipolmoment. Kulsyre mangler også et molekylært dipolmoment.
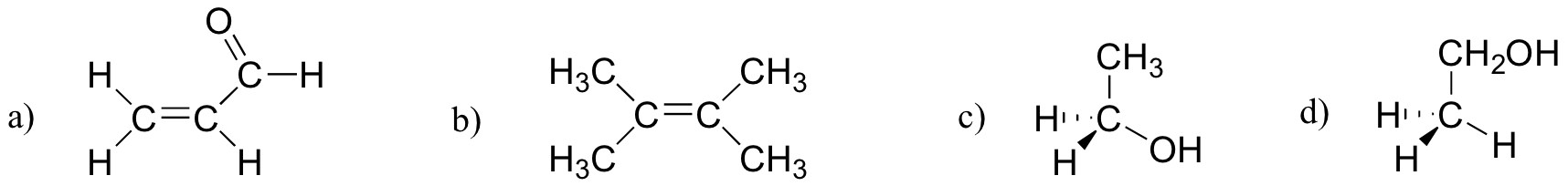
øvelse 2.27
hvilke af molekylerne nedenfor har molekylære dipolmomenter?
løsninger til øvelser