Facts, Resume & Definition
- et adduct er et produkt dannet af en additionsreaktion
- Adducts kan kun dannes af reaktanter, der har flere bindinger, såsom alkener og carbonylgrupper
- Adducts kan dannes gennem to typer af adducts, der er af additionsreaktion: elektrofil og nukleofil
- addukter dannes ofte mellem Livis syrer og Livis baser
Hvad er et addukt?
et addukt er et produkt dannet i slutningen af en additionsreaktion. Dette er en reaktion, hvor to eller flere molekyler reagerer og kombineres for at danne et større produkt. Denne type reaktion kan kun forekomme mellem kemiske forbindelser, der har flere bindinger – forbindelser som alkener (dobbeltbindinger) og alkyner (tredobbelte bindinger). Carbonyl (C=O) og Imin (C=N) grupper kan også gennemgå additionsreaktioner og således danne addukter.
hvordan dannes addukter?
som nævnt før dannes addukter gennem additionsreaktioner. I denne type reaktion bryder dobbeltbindingen delvist, når et reagerende molekyle angriber og tilføjer. Reaktionen nedenfor viser en additionsreaktion mellem ethen og brom.

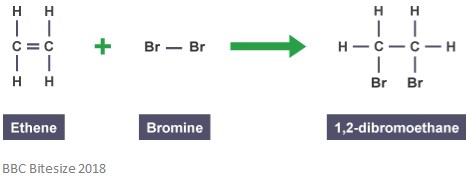
adduktet i denne reaktion er 1,2-dibromethan. Dette skyldes, at det er en særskilt art, der indeholder alle atomer af alle komponenter.
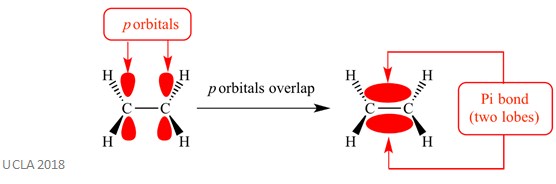
disse additionsreaktioner involverer normalt pi-bindinger. Dette er en kompleks type binding, hvor p – orbitalerne på tilstødende atomer overlapper hinanden-det er denne overlapning, der forårsager pi-bindingen. Dette sker vinkelret på enhver sigma-binding mellem disse to samme atomer. Denne pi-binding har også to orbitallober – den ene er over Sigma-bindingens plan, og den anden er under Sigma-bindingens plan. Pi-bindingen er vist i diagrammet nedenfor.

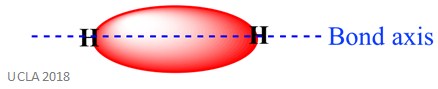
den samme reaktion kan også involvere Sigma-obligationer. Dette er en type kovalent bindingsform ved overlapning af atomorbitaler langs bindingsaksen – med andre ord langs linjen, der forbinder de to bundne atomer. For eksempel dannes sigma – bindingen i et hydrogenatom ved overlapning af to 1s orbitaler-en fra hvert hydrogenatom. Dette er bedre vist på billedet nedenfor-det røde område vist sigma bond.

der er to hovedtyper af additionsreaktion: elektrofil tilsætning og nukleofil tilsætning.
elektrofil tilsætning
en elektrofil additionsreaktion er en type reaktion, hvor en binding brydes, og der dannes to nye bindinger. Som diskuteret tidligere skal reaktanten have en dobbelt eller tredobbelt binding – elektrofilen tilføjer en pi-binding i dette tilfælde. Dette er en additionsreaktion, og derfor går intet tabt i processen – alle atomer, der findes i reaktantmolekylerne, findes også i adduktet.

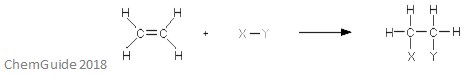
ovenstående billede viser den grundlæggende af en elektrofil additionsreaktion. Som du kan se, findes alle atomer i reaktanterne i adduktet.
nukleofil tilsætning
en nukleofil additionsreaktion er en type reaktion, hvor en dobbeltbinding brydes, og der dannes to enkeltbindinger. En elektronmangel (elektrofil) dobbelt eller tredobbelt binding reagerer med noget, der er elektronrig (nukleofil). Nukleofilen tilføjer en pi-binding i dette tilfælde. Et eksempel på en nukleofil additionsreaktion er vist nedenfor.

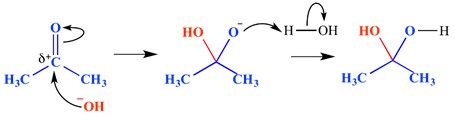
i dette eksempel har en hydroksidion tilføjet til den delta positive ende af carbonylgruppen – dette har dannet et iltet tetraedrisk mellemmolekyle. Slutresultatet er derfor tilsætningen af vand på tværs af carbonylgruppens pi-binding.
Addukker er ofte kendt for at danne mellem Levis syrer og Levis baser. Det dannede molekyle kaldes et Syrebaseaddukt (eller et Syrebasekompleks). Da addukter kun dannes gennem additionsreaktioner (dvs.uden samtidig tab af en gruppe), kan Levis-syre-og Levis-basereaktioner ikke være af substitutionstypen.
et godt eksempel på dette er reaktionen mellem THF og BH3, som er vist på billedet nedenfor. Som du vil se, vises disse Baseaddukker med prikker-disse repræsenterer elektroner.

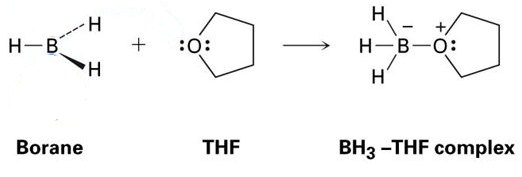
som du kan se, er det eneste dannede produkt BH3-THF-komplekset, hvilket betyder, at det er en addukt.
disse typer reaktioner kan også afbildes med pile – disse pile repræsenterer donation af elektroner fra basen til syren. Den samme reaktion er vist nedenfor, men med pile for at indikere elektrondonation.

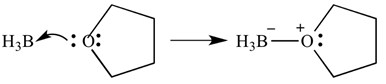
det er vigtigt at bemærke her, at disse pile har to ‘modhager’ på den spidse ende. Dette indikerer, at et par elektroner er blevet doneret. Hvis kun en elektron doneres, vil pilen kun have ‘en’ bard på den spidse ende.
i dette tilfælde er Levis-syren Boran, og Levis-basen er THF. Som du kan se, har basen doneret et ensomt par elektroner til syren for at danne en ilt-borbinding.forbindelser, der ikke er i stand til at danne addukter på grund af molekylernes form, kaldes frustrerede par.
yderligere læsning
http://www.chem.ucla.edu/~harding/IGOC/L/lewis_acid_base_adduct.html