Vivo Patofysiologi
andre emner
Akvaporiner: vandkanaler
vand krydser cellemembraner ad to veje: ved diffusion gennem lipiddobbeltlaget og gennem vandkanaler kaldet akvaporiner. Funktionel karakterisering af det første akvaporin blev rapporteret i 1992, men vandkanaler blev mistænkt for at eksistere længe før den tid, fordi den osmotiske permeabilitet af nogle typer epitelceller var alt for stor til at blive redegjort for ved simpel diffusion gennem plasmamembranen.
en enkelt menneskelig akvaporin-1-kanal Letter vandtransport med en hastighed på cirka 3 milliarder vandmolekyler pr. En sådan transport ser ud til at være tovejs i overensstemmelse med den fremherskende osmotiske gradient.
de klassiske akvaporiner transporterer opløst vand over cellemembraner; de ser ud til at være eksklusive vandkanaler og gennemsyrer ikke membraner til ioner eller andre små molekyler. Nogle akvaporiner – kendt som akvaglyceroporiner-transporterer vand plus glycerol og et par andre små molekyler.
Akvaporinfamilien
mere end 10 forskellige akvaporiner fra pattedyr er blevet identificeret til dato, og yderligere medlemmer mistænkes for at eksistere. Nært beslægtede vandkanalproteiner er blevet isoleret fra planter, insekter og bakterier. Akvaporin – 1 fra humane røde blodlegemer var den første, der blev opdaget og er sandsynligvis den bedst studerede.
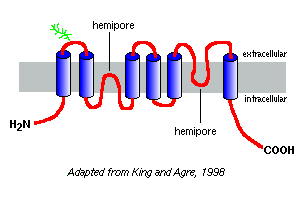
Hydrofobicitetsplotter af deres aminosyresekvenser forudsiger, at akvaporinerne har seks membranspændende segmenter, som afbildet i modellen af akvaporin-1 til højre.
baseret på undersøgelser med akvaporin-1 ser det ud til, at akvaporiner findes i plasmamembranen som homotetrammere. Hver akvaporinmonomer indeholder to hemi-porer, som foldes sammen for at danne en vandkanal.
forskellige akvaporiner har forskellige mønstre af glycosylering. I tilfælde af akvaporin-1 er peptidrygraden omtrent 28 kDa, og de glycosylerede former varierer fra 40 til 60 kDa i masse. De fleste akvaporiner har en proteinkinase et phosphoryleringsmotiv i en af de cytoplasmatiske sløjfer, og der er mistanke om differentiel phosphorylering empart en regulerende funktion til molekylet.
mønstre af Akvaporinekspression
hver af akvaporinerne har et i det væsentlige unikt ekspressionsmønster blandt væv og under udvikling. En oversigt over disse attributter og nogle af de vigtige potentielle eller kendte funktioner er præsenteret i følgende tabel:
| Store Ekspressionssteder | ||
|---|---|---|
| Akvaporin-0 | øje: linsefiberceller | væskebalance i linsen |
| akvaporin-1 | røde blodlegemer | osmotisk beskyttelse |
| nyre: proximal tubule | Concentration of urine | Eye: ciliary epithelium | Production of aqueous humor | Brain: choriod plexus | Production of cerebrospinal fluid | Lung: alveolar epithelial cells | Alveolar hydration state |
| Aquaporin-2 | Kidney: collecting ducts | Mediates antidiuretic hormone activity |
| Aquaporin-3 * | Kidney: collecting ducts | Reabsorbtion of water into blood |
| Trachea: epitelceller | sekretion af vand i luftrøret | |
| Akvaporin-4 | nyre: opsamlingskanaler | Reabsorbtion af vand |
| hjerne: ependymale celler | CSF væskebalance | |
| hjerne: hypothalamus | osmosenseringsfunktion? | |
| Lung: bronkialepitel | Bronkialvæskesekretion | |
| Akvaporin-5 | spytkirtler | |
| Lacrimal kirtler | produktion af tårer | |
| Akvaporin-6 | nyre | meget lav vandpermeabilitet; funktion? |
| Akvaporin-7 * | fedtceller | transporterer glycerol ud af adipocytter |
| Testis og sæd | ||
| Testis, bukspyttkjertel, lever, andre | ||
| akvaporin-9 * | ||
| * en akvaglyceroporin | ||
det skal være klart, at akvaporiner er meget udbredt, og også at de forskellige Akvaporiner har forskellige funktionelt vigtige specialiteter.
flere interessante og vigtige træk ved akvaporin-medieret vandtransport er illustreret i de vigtigste celler, der leder opsamlingskanaler i nyrerne. Vand, der strømmer gennem disse kanaler, kan enten fortsætte og blive annulleret i urinen eller reabsorberes over epitelet og tilbage i blodet. Reabsorption er i det væsentlige nul, medmindre epitelcellerne ser antidiuretisk hormon, som stærkt stimulerer reabsorption af vand. Opsamling af kanalceller udtrykker mindst to akvaporiner:Akvaporin – 2 syntetiseres, men i fravær af antidiuretisk hormon ligger i en pulje af membranvesikler i cytoplasmaet. Binding af antidiuretisk hormon til dets receptor i cellen stimulerer ikke kun transkription af akvaporin-2-genet, men forårsager, at den intracellulære pool af akvaporin-2 indsættes i den apikale membran. Cellen er nu i stand til effektivt at optage vand fra kanalens lumen.Akvaporin – 3 udtrykkes konstitutivt i cellens basolaterale membran. Når vand strømmer ind i cellen gennem akvaporin – 2-kanaler, kan det hurtigt forlade cellen gennem akvaporin-3-kanalerne og strømme ind i blodet. 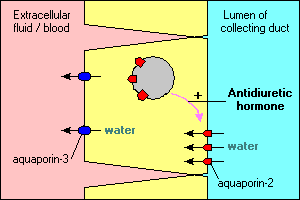
Akvaporiner og sygdom
i betragtning af vigtigheden af vandtransport i et utal af fysiologiske processer kan det forventes, at læsioner i akvaporingener eller erhvervet dysfunktion i akvaporiner kan forårsage eller bidrage til flere sygdomstilstande. Søgningen efter sådanne forbindelser er stadig tidligt, men to klare eksempler på sygdom er blevet identificeret som følge af mangel på akvaporiner:mutationer i akvaporin-2-genet forårsager arvelig nefrogen diabetes insipidus hos mennesker.
et lille antal mennesker er blevet identificeret med alvorlig eller total mangel i akvaporin-1. Interessant nok forekommer de klinisk upåvirket, men er ikke blevet undersøgt under betingelser med vandmangel. Mus med målrettede sletninger i akvaporin-1 forekommer også normale og sunde, medmindre de er væskebegrænsede, i hvilket tilfælde de bliver alvorligt hyperosmolære.
referencer og anmeldelser
- Borgnia M, Nielsen s, Engel a, Agre P: cellulær og molekylærbiologi af akvaporinvandskanaler. Annu Rev Biochem 68: 425, 1999.
- deGroot BL, Grubmuller H: vandgennemtrængning på tværs af biologiske membraner: mekanisme og dynamik af akvaporin-1 og GlpF. Videnskab 294:2353, 2001.Hibuse T, Proc Nat Acad Sci (USA) 102:10993, 2005.
- King LS, Agre P: Patofysiologi af akvaporinvandkanalerne. Annu Rev Physiol 58: 619, 1998.
- Knepper MA, Inoue T: regulering af akvaporin-2 vandkanalhandel med vasopressin. Curr Udtalelse Celle Biol 9: 560, 1997.Lee MD, King LS, Agre P: akvaporinfamilien af vandkanalproteiner i klinisk medicin. Medicin 76: 141, 1997.Preston GM, Carroll TP, Guggino Agre P: udseende af vandkanaler i Ksenopus oocytter, der udtrykker røde blodlegemer CHIP28 protein. Videnskab 256: 385, 1992.
- Sasaki S, Ishibashi K, Marumo F: Akvaporin-2 og -3: repræsentanter for to undergrupper af akvaporinfamilien kolokaliseret i nyreopsamlingskanalen. Annu Rev Physiol 60:199, 1998.