Sir,
pladecellecarcinomer (SCC) i huden er hyppige ondartede hudtumorer med en forekomst på 30 pr.100.000 indbyggere om året i Vesteuropa. I mere solrige klimaer er de endnu hyppigere. SCC udvikler sig normalt fra aktiniske keratoser. Ud over sollys omfatter andre prædisponerende faktorer ioniserende stråling, kronisk inflammation med ardannelse, virusinfektioner og immunosuppression. Organtransplantationspatienter har en markant øget risiko, måske 200 gange, for at udvikle SCC på grund af deres immunsuppressive behandling (1). Det samme gælder for patienter med immundefekt på grund af andre faktorer, for eksempel dem med HIV-infektion (1, 2).
CASE REPORT
en 50-årig mand præsenterede en stor tumor på hans venstre kind, som havde udviklet sig i løbet af de sidste 3 måneder. Tumoren havde en hævet kant og et centralt udstanset sår. Han havde rejst i Tunesien 6 måneder tidligere med meget soleksponering. Selvom han havde hud type II, havde han aldrig praktiseret solbeskyttelse. Klinisk undersøgelse afslørede ikke yderligere tegn på aktinisk skade; specifikt havde han ingen aktiniske keratoser. Siden hans ophold i Tunesien havde patienten også en kronisk tør hoste. Hans cervikale lymfeknuder var normale ved palpation og med ultralydundersøgelse. Magnetisk resonanstomografi viste ingen infiltration af tilstødende bløde vævsstrukturer. På grund af den hurtige vækst i tumoren og dens makroskopiske udseende mistænkte vi et keratoacanthoma. Histologisk undersøgelse afslørede en veldifferentieret, men ulcereret SCC. Strømningscytometrisk analyse af perifere T-celler afslørede en ubalance med kun 5 CD4+/CD3+-celler og 226 CD8+/CD3+ celler (forhold 0,02), hvilket indikerer immundefekt og måske forklarer den hurtige vækst af tumoren. På trods af omfattende rådgivning om en potentielt underliggende immunsuppressiv sygdom afviste patienten yderligere hiv-diagnostiske procedurer samt yderligere undersøgelser for at afklare hosten (mistænkt Pneumocystis jiroveci pneumoni) og udelukke metastaser. Han afviste også genudskæring med bredere margener og forlod hospitalet mod lægehjælp.

Fig. 1. Den venstre kind af en 50-årig mand med en stor tumor. (a) Dorsal og (B) lateral aspekt.
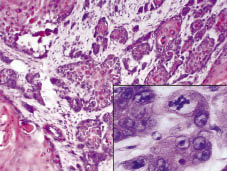
Fig. 2. Histologisk undersøgelse afslørede en dyb infiltrerende tumor, der ødelagde de læsionsmæssige anatomiske strukturer. Indsæt: tumoren er sammensat af polymorfe keratinocytter med flere mitoser (H&E-200, med digital forstørrelse).
diskussion
Keratoacanthoma (KA) blev først beskrevet i 1889 af Jonathan Hutchinson som krateriform sår i ansigtet. Det optræder oftest som en hurtigt voksende hudtumor på soleksponerede områder (3). Mænd er ramt omkring 3 gange oftere end kvinder. Den justerede aldersfordeling viser, at den er hyppigst i middelalderen og ikke stiger i forekomsten hos ældre (i modsætning til basalcellekarcinom og SCC) (4). Mens SCC udvikler sig fra overfladeepitel, stammer KAs fra hårsækkevæggen lige over, hvor talgkanalen kommer ind. De er en særskilt enhed med specifikke kliniske og histologiske træk (5). Tendensen til spontan regression og den omfattende grad af keratinisering er de mest slående træk sammen med tumorens typiske symmetriske arkitektur (6).
den nøjagtige nosologi og klassificering af KA er et spørgsmål om debat. Nogle forfattere betragter KA som en godartet kutan tumor, der er prototypen på de “pseudomalarne” tumorer i huden, mens andre hævder, at det er ondartet neoplasma – en ejendommelig variant af SCC – og derfor bør behandles som SCC (7-9). De diagnostiske vanskeligheder gælder især for de destruktive, vedvarende varianter af KA, såsom kæmpe KA eller lemlæstende ka. Klinisk er KA differentieret fra SCC ved sin historie med hurtig vækst og dens vulkanlignende form. I det her beskrevne tilfælde viste en stor SCC imidlertid også meget hurtig vækst, muligvis på grund af HIV-infektion. Nogle gange skal læsioner, der betragtes som KAs, omklassificeres som SCC ‘ er på grundlag af deres efterfølgende kliniske forløb. Ud over en fejlagtig diagnose er andre forklaringer kombinationen af KA og SCC samt omdannelsen af KA til SCC. Desuden kan nogle KAs være veldifferentierede varianter af SCC ‘ er, som foreslået af Ackerman (10-12).
på grund af vanskelighederne med at skelne mellem KA og SCC er den valgte behandling for alle typer KAs stadig kirurgisk udskæring med histopatologisk verifikation af diagnosen (8-10). Hvis operation er umulig, kan ioniserende stråling overvejes. Flere andre terapeutiske muligheder, såsom topisk 5-fluorouracil, intra-lesional injektioner af interferon-alfa, methotreksat eller bleomycin og systemisk administrerede retinoider, er rapporteret at være effektive i individuelle tilfælde, men der er ingen kontrollerede kliniske forsøg, der viser effektiviteten af disse behandlinger (1, 4, 5).
nogle SCC ‘ er kan vokse hurtigt og efterligne en KA, som i det tilfælde, der er beskrevet her. Årsagen til den hurtige vækst af KAs er uklar; flere hypoteser er blevet tilbudt, herunder immunsuppression og udsættelse for overdreven sollys. KAs, især dem, der ikke klart kan skelnes fra SCC, bør behandles ved bred kirurgisk udskæring, da de kan have en ugunstig prognose med tidlig udvikling af metastaser.
1. Sterry V, Stockfleth E. Maligne epitheliale tumor. I: Braun-Falco O, Plevig G, Ulf HH, Burgdorf HH, Landthaler M, redaktører. Dermatologi og kønssygdomme. 5. udgave. Heidelberg: Springer, 2005: s. 1267-1276.
2. Nguyen P, Vin-Christian K, Ming ME, Berger T. Aggressive pladecellecarcinomer hos personer inficeret med den humane immundefektvirus. Arch Dermatol 2002; 138: 758–763.
3. Rinker MH, Fenske NA, Scalf LA, glas LF. Histologiske varianter af pladecellecarcinom i huden. Kræft Kontrol 2001; 8: 354-363.
4. Mac Kie RM. Ikke-melanom hudkræft og epidermale hudtumorer. I: Burns T, Breathnack S, koks N, Griffiths C, redaktører. Rooks lærebog om dermatologi. 7. udgave. Massachusetts: Sort godt videnskab, 2004: s. 43-46.
5. Kurschat P, Hess S, Hunselmann N, Scharffetter-Kochanek K. Keratoacanthoma centrifugum marginatum ledsaget af omfattende granulomatøs fremmedlegemsreaktion. Dermatol Online J 2005; 11: 16.
6. Bayer-Garner IB, Ivan D, Schvarts MR, Tschen JA. Immunopatologien af regression i godartet lichenoid keratose, keratoacanthoma og halo nevus. Clin Med Res 2004; 2: 89-97.
7. Cribier B, Asch P, Grosshans E. differentiering af pladecellecarcinom fra keratoacanthoma ved hjælp af histopatologiske kriterier. Er det muligt? En undersøgelse af 296 tilfælde. Dermatologi 1999; 199: 208-212.
8. Beham a, Regauer S, Soyer HP, Beham-Schmid C. Keratoacanthoma: en klinisk særskilt variant af godt differentieret pladecellecarcinom. Adv Anat Pathol 199; 5: 269-280.
9. Blomster F, Ramos-Caro FA. Solitært keratoacanthoma (pladecellecarcinom): kirurgisk behandling. Int J Dermatol 1995; 34: 17-19.
10. Hodak E, Jones RE, Ackerman AB. Solitært keratoacanthoma er et pladecellecarcinom:tre eksempler med metastaser. Am J Dermatopathol 1993; 15: 332-342.
11. Sanches YE, Simon P, Rekvena L, Ambrojo P, de Eusebio E. Solitary keratoacanthoma: en selvhelbredende spredning, der ofte bliver ondartet. Am J Dermatopathol 2000; 22: 305-310.
12. Reed RJ. Aktinisk keratoacanthoma. Spekulationer om læsionens art og den rolle, som cellulær immunitet spiller i dens udvikling. Am J Dermatopathol 1990; 12: 517-533.