Generic Name: epinastine hydrochloride
Dosage Form: ophthalmic solution
Medically reviewed by Drugs.com. Last updated on June 1, 2020.
- Overview
- Side Effects
- Dosage
- Professional
- Pregnancy
- More
Indications and Usage for Epinastine HCl Ophthalmic Solution
Epinastine HCl Ophthalmic Solution 0.05% er indiceret til forebyggelse af kløe forbundet med allergisk konjunktivitis.
Epinastin HCl oftalmisk opløsning Dosering og Administration
den anbefalede dosis er en dråbe i hvert øje to gange dagligt.
behandlingen bør fortsættes i hele eksponeringsperioden (dvs.indtil pollensæsonen er forbi, eller indtil eksponeringen for det krænkende allergen er afsluttet), selv når symptomerne er fraværende.
doseringsformer og styrker
opløsning indeholdende 0.5 mg/mL epinastin HCl
kontraindikationer
ingen
advarsler og forsigtighedsregler
kontaminering af spids og opløsning
patienter skal instrueres i at undgå, at spidsen af dispenseringsbeholderen kommer i kontakt med øjet, omgivende strukturer, fingre eller andre overflader for at undgå kontaminering af opløsningen med almindelige bakterier, der vides at forårsage okulære infektioner. Alvorlig skade på øjet og efterfølgende synstab kan skyldes brug af forurenede opløsninger.
flasken skal holdes tæt lukket, når den ikke er i brug.
brug med kontaktlinser
patienter bør rådes til ikke at bære kontaktlinser, hvis deres øje er rødt. Epinastin HCl oftalmisk opløsning 0,05% bør ikke anvendes til behandling af kontaktlinserelateret irritation.konserveringsmidlet i Epinastin HCl oftalmisk opløsning 0,05%, kan absorberes af bløde kontaktlinser. Kontaktlinser skal fjernes inden instillation af Epinastin HCl oftalmisk opløsning 0,05% og kan genindsættes efter 10 minutter efter administrationen.
kun lokal oftalmisk brug
Epinastin HCl oftalmisk opløsning 0.05% er kun til topisk oftalmisk brug og ikke til injektion eller oral brug.
bivirkninger
kliniske studier erfaring
da kliniske studier udføres under vidt forskellige forhold, kan bivirkningshastigheder observeret i de kliniske studier af et lægemiddel ikke sammenlignes direkte med satser i de kliniske studier af et andet lægemiddel og afspejler muligvis ikke de satser, der er observeret i praksis.
de hyppigst rapporterede okulære bivirkninger, der forekom hos ca.1-10% af patienterne, var brændende fornemmelse i øjet, folliculose, hyperæmi og kløe.
de hyppigst rapporterede non-okulære bivirkninger var infektion (forkølelsessymptomer og øvre luftvejsinfektioner), som blev set hos ca.10% af patienterne, og hovedpine, rhinitis, sinusitis, øget hoste og pharyngitis, som blev set hos ca. 1 – 3% af patienterne.
Nogle af disse reaktioner svarede til den underliggende sygdom, der blev undersøgt.
erfaring efter markedsføring
følgende reaktioner er identificeret under brug efter markedsføring af Epinastin HCl Ophthalmic Solution 0,05% i klinisk praksis. Da de rapporteres frivilligt fra en population af ukendt størrelse, kan der ikke foretages skøn over hyppigheden. Reaktionerne, som er valgt til inklusion på grund af enten deres alvorlighed, rapporteringshyppighed, mulig årsagsforbindelse til Epinastin HCl oftalmisk opløsning 0, 05% eller en kombination af disse faktorer, inkluderer: øget lakrimation.
anvendelse i specifikke populationer
graviditet
teratogene virkninger
graviditetskategori C
i et embryofetal udviklingsstudie med drægtige rotter blev maternel toksicitet uden embryofetale virkninger observeret ved en oral dosis, der var ca.150.000 gange den maksimale anbefalede humane okulære dosis (MROHD) på 0,0014 mg/kg/dag på mg/kg basis. Total resorption og abort blev observeret i et embryofetal studie hos drægtige kaniner ved en oral dosis, der var ca.55.000 gange mrohd. I begge undersøgelser blev der ikke observeret nogen lægemiddelinduceret teratogen virkning.
Epinastin reducerede vægtøgning hos ungerne efter en oral dosis til drægtige rotter, som var ca.90.000 gange mrohd.
der er dog ingen tilstrækkelige og velkontrollerede undersøgelser hos gravide kvinder. Da dyreproduktionsundersøgelser ikke altid er forudsigelige for humant respons, bør Epinastin HCl Ophthalmic Solution 0, 05% kun anvendes under graviditet, hvis den potentielle fordel berettiger den potentielle risiko for fosteret.
ammende mødre
et studie med diegivende rotter afslørede udskillelse af epinastin i modermælken. Det vides ikke, om dette lægemiddel udskilles i modermælk. Da mange lægemidler udskilles i modermælk, skal der udvises forsigtighed, når Epinastin HCl oftalmisk opløsning 0,05% administreres til en ammende kvinde.
pædiatrisk anvendelse
sikkerhed og effektivitet hos pædiatriske patienter under 2 år er ikke fastlagt.
geriatrisk anvendelse
der er ikke observeret nogen overordnede forskelle i sikkerhed eller effektivitet mellem ældre og yngre patienter.
Epinastin HCl oftalmisk opløsning beskrivelse
Epinastin HCl oftalmisk opløsning 0.05% is a clear, colorless, sterile isotonic solution containing epinastine HCl, an antihistamine and an inhibitor of histamine release from the mast cell for topical administration to the eyes.
Epinastine HCl is represented by the following structural formula:
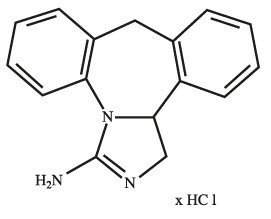
C16H15N3HCl Mol. Wt. 285.78
Chemical Name:
3-Amino-9,13b-dihydro-1H-dibenzimidazoazepine hydrochloride
Each mL contains: Active: Epinastine HCl 0.05% (0.5 mg/mL) equivalent to epinastine 0.044% (0.44 mg/mL); Preservative: Benzalkonium chloride 0.01%; Inactives: Edetat dinatrium, dihydrat; renset vand; natriumchlorid; natriumphosphat, monobasisk, vandfri; og natriumhydroksid og / eller saltsyre (for at justere pH).
Epinastin HCl oftalmisk opløsning 0,05% har en pH på cirka 7 og et osmolalitetsområde på 250 til 310 mOsm / kg.
Epinastin HCl oftalmisk opløsning – Klinisk Farmakologi
virkningsmekanisme
Epinastin er en topisk aktiv, direkte H1-receptorantagonist og en hæmmer af frigivelsen af histamin fra mastcellen. Epinastin er selektivt for histamin H1-receptoren og har affinitet for histamin H2-receptoren. Epinastin har også affinitet for de Rp1 -, RP2-og 5–HT2-receptorer.
farmakokinetik
fjorten forsøgspersoner med allergisk konjunktivitis modtog en dråbe Epinastin HCl oftalmisk opløsning 0,05% i hvert øje to gange dagligt i 7 dage. På dag 7 blev den gennemsnitlige maksimale epinastin-plasmakoncentration på 0,04 g 0,014 ng/ml nået efter ca.to timer, hvilket indikerer lav systemisk eksponering. Mens disse koncentrationer repræsenterede en stigning i forhold til dem, der blev set efter en enkelt dosis, var Dag 1-og dag 7-området under kurven (AUC) – værdierne uændrede, hvilket indikerer, at der ikke er nogen stigning i systemisk absorption ved multiple doser. Epinastin er 64% bundet til plasmaproteiner. Den totale systemiske clearance er ca.56 L/time, og den terminale plasmaeliminationshalveringstid er ca. 12 timer. Epinastin udskilles hovedsageligt uændret. Cirka 55% af en intravenøs dosis genvindes uændret i urinen med omkring 30% i afføring. Mindre end 10% metaboliseres. Renal eliminering sker hovedsageligt via aktiv tubulær sekretion.
ikke-klinisk Toksikologi
carcinogenese, mutagenese, nedsat fertilitet
i 18-måneders eller 2-årige karcinogenicitetsstudier med henholdsvis mus eller rotter var epinastin ikke carcinogent ved doser op til 40 mg / kg .
Epinastin i nyligt syntetiserede batcher var negativt for mutagenicitet i Ames / Salmonella-analysen og in vitro-kromosomafvigelsesanalysen ved anvendelse af humane lymfocytter. Positive resultater blev set med tidlige batcher af epinastin i to in vitro kromosomale aberrationsstudier udført i 1980 ‘ erne med henholdsvis humane perifere lymfocytter og med V79-celler. Epinastin var negativt i In vivo-clastogenicitetsstudierne, herunder mikronukleus-analysen hos mus og kromosomafvigelsesanalysen hos kinesiske hamstere. Epinastin var også negativt i celletransformationsanalysen ved hjælp af syriske hamsterembryoceller, V79/HGPRT pattedyrscellepunktsmutationsassay og in vivo/in vitro uplanlagt DNA-synteseanalyse ved hjælp af primære hepatocytter fra rotter.
Epinastin havde ingen effekt på fertiliteten hos hanrotter. Nedsat fertilitet hos hunrotter blev observeret ved en oral dosis på op til ca.90.000 gange mrohd.
kliniske studier
Epinastin HCl 0, 05% har vist sig at være signifikant bedre end køretøjet til forbedring af okulær kløe hos patienter med allergisk konjunktivitis i kliniske studier ved hjælp af to forskellige modeller: (1) konjunktival antigen challenge (CAC), hvor patienter blev doseret og derefter modtaget antigen indpodet i den ringere konjunktival; og (2) miljøfeltundersøgelser, hvor patienter blev doseret og evalueret i løbet af allergisæsonen i deres naturlige habitat. Resultaterne viste en hurtig indsættende virkning for epinastin HCl 0,05% inden for 3 til 5 minutter efter konjunktival antigenudfordring. Virkningens varighed blev vist at være 8 timer, hvilket gjorde et regime to gange dagligt egnet. Dette doseringsregime blev vist at være sikkert og effektivt i op til 8 uger uden tegn på takyfylakse.
hvordan leveret / opbevaring og håndtering
Epinastin HCl oftalmisk opløsning 0.05% leveres sterilt i uigennemsigtige hvide LDPE plastflasker med dråbespidser og hvide polypropylen (PP) hætter som følger:
| 5 mL i 10 mL flaske | NDC 51991-836-75 |
Opbevaring: Opbevares ved 20 kr – 25 kr (68 kr – 77 kr) . Hold flasken tæt lukket og utilgængeligt for børn.
Patientrådgivningsinformation
sterilitet af Dropper Tip
patienter bør rådes til ikke at røre dropper tip til nogen overflade, da dette kan forurene indholdet (se advarsler og forsigtighedsregler, 5.1).
samtidig brug af kontaktlinser
patienter bør rådes til ikke at bære kontaktlinser, hvis deres øje er rødt. Patienter bør informeres om, at Epinastin HCl Ophthalmic Solution 0,05% ikke bør anvendes til behandling af kontaktlinserelateret irritation. Patienter bør også rådes til at fjerne kontaktlinser før instillation af Epinastin HCl oftalmisk opløsning 0,05%.konserveringsmidlet i Epinastin HCl oftalmisk opløsning 0,05%, kan absorberes af bløde kontaktlinser. Linser kan genindsættes efter 10 minutter efter administration af Epinastin HCl oftalmisk opløsning 0,05%
kun lokal oftalmisk brug
kun til topisk oftalmisk administration.distribueret af:
Breckenridge Pharmaceutical, Inc.
Berlin, CT 06037
fremstillet af:
PrimaPharma, Inc.
San Diego, CA 92121
Rev: 04/2020
2323 04/20
PRINCIPAL DISPLAY PANEL – 5 mL Bottle Carton
NDC 51991-836-75
Epinastine HCl
Ophthalmic
Solution,
0.05%
FOR USE IN THE
EYES ONLY
sterile
Rx Only
5 mL sterile
breckenridge
A Towa
Company

| EPINASTINE HYDROCHLORIDE epinastine hydrochloride solution/ drops |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Labeler – Breckenridge Pharmaceutical, Inc. (150554335)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| PrimaPharma, Inc. | 079699106 | MANUFACTURE(51991-836) | |
mere om epinastine ophthalmic
- bivirkninger
- under graviditet eller amning
- doseringsinformation
- prissætning & kuponer
- på Engelsk
- 3 anmeldelser
- lægemiddelklasse: oftalmiske antihistaminer og dekongestanter
Forbrugerressourcer
- patientinformation
- Epinastin oftalmisk (avanceret læsning)
professionelle ressourcer
- ordineringsinformation
- Epinastin (professionel patientrådgivning)
andre mærker Elestat
relaterede behandlingsvejledninger
- konjunktivitis, allergisk
medicinsk ansvarsfraskrivelse