kemisk kinetik
kemisk kinetik
Du kan være bekendt med syre-base titreringer, der bruger phenolphthalein som slutpunktsindikatoren. Du har måske ikke bemærket, hvad der sker, når en løsningder indeholder phenolphthalein i nærvær af overskydende base får lov til at stå for et parminutter. Selvom opløsningen oprindeligt har en lyserød farve, bliver den gradvist farveløs somphenolphthalein reagerer med OH – ion i en stærkt basisk opløsning.
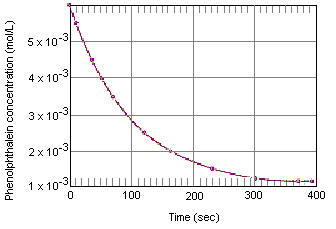
tabellen nedenfor viser, hvad der sker med koncentrationen af phenolphthaleinin en opløsning, der oprindeligt var 0,005 M i phenolphthalein og 0,61 M i OH-ion. Som du kan se, når disse data er afbildet i nedenstående graf, falder phenolphthaleinkoncentrationen med en faktor på 10 over en periode på ca.fire minutter.
Experimental Data for the Reaction Between Phenolphthalein and ExcessBase
| Concentration of Phenolphthalein (M) |
Time (s) | |
| 0.0050 | 0.0 | |
| 0.0045 | 10.5 | |
| 0.0040 | 22.3 | |
| 0.0035 | 35.7 | |
| 0.0030 | 51.1 | |
| 0.0025 | 69.3 | |
| 0.0020 | 91.6 | |
| 0.0015 | 120.4 | |
| 0.0010 | 160.9 | |
| 0.00050 | 230.3 | |
| 0.00025 | 299.6 | |
| 0.00015 | 350.7 | |
| 0.00010 | 391.2 |
eksperimenter som den, der gav os dataene i ovenstående tabel, erklassificeret som målinger af kemisk kinetik (fra en græsk stamme, der betyder “tomove”). Et af målene med disse eksperimenter er at beskrive reaktionshastighedenden hastighed, hvormed reaktanterne omdannes til reaktionsprodukterne.
udtrykket Sats bruges ofte til at beskrive ændringen i en mængdeder forekommer pr.tidsenhed. Inflationen er for eksempel ændringen igennemsnitlige omkostninger ved en samling af standardposter om året. Den hastighed, hvormed et objektrejser gennem rummet er den tilbagelagte afstand pr.tidsenhed, såsom miles i timen ellerkilometer pr. sekund. I kemisk kinetik er den tilbagelagte afstand ændringen ikoncentration af en af reaktionens komponenter. Reaktionshastigheden er derfor ændringen i koncentrationen af en af reaktanterne![]() (h)
(h)![]() der forekommer i en given tidsperiode
der forekommer i en given tidsperiode![]() t.
t.
![]()
øvelsesproblem 1:
brug dataene i ovenstående tabel til at beregne den hastighed, hvormed phenolphthalein reagerer med Oh – Ion i hver af de følgende perioder:
(A) i det første tidsinterval, når phenolphthaleinkoncentrationen falder fra 0,0050 m til 0,0045 M.
(b) i det andet interval, når koncentrationen falder fra 0,0045 M til 0,0040 M.
(c) i det tredje interval, når koncentrationen falder fra 0,0040 M til 0,0035 M.
Klik her for at kontrollere dit svar på Øvelsesproblem 1.
Klik her for at se en løsning til praksis Problem 1.
![]()
øjeblikkelige reaktionshastigheder og Ratelagen for en reaktion
reaktionshastigheden mellem phenolphthalein og OH-ion er ikke konstant; det ændrer sig med tiden. Ligesom de fleste reaktioner, hastigheden af denne reaktiongradvist falder som reaktanterne forbruges. Det betyder, at reaktionshastighedenændrer sig, mens den måles.
for at minimere den fejl, dette introducerer i vores målinger, synes det tilrådeligt at måle reaktionshastigheden over perioder, der er korte sammenlignet med den tid det tager for reaktionen at forekomme. Forsøge at måle den uendelige lille ændring i koncentration![]() d(H)
d(H)![]() der forekommer over en uendelig kort periode. Forholdet mellem dissemængder er kendt som den øjeblikkelige reaktionshastighed.
der forekommer over en uendelig kort periode. Forholdet mellem dissemængder er kendt som den øjeblikkelige reaktionshastighed.
![]()
den øjeblikkelige reaktionshastighed til enhver tid kan beregnesfra en graf af koncentrationen af reaktanten (eller produktet) versus tid. Grafen nedenfor viser, hvordan reaktionshastigheden for nedbrydning af phenolphthalein kan beregnes ud fra en graf over koncentration versus tid. Reaktionshastigheden til enhver tidi tiden er lig med hældningen af en tangent trukket til denne kurve i det øjeblik.

den øjeblikkelige reaktionshastighed kan måles til enhver tid mellemøjeblik, hvor reaktanterne blandes, og reaktionen når ligevægt.Ekstrapolering af disse data tilbage til det øjeblik, hvor reagenserne blandes, giver den initialinstantane reaktionshastighed.
![]()
Sats love og hastighedskonstanter
et interessant resultat opnås, når den øjeblikkelige reaktionshastighedberegnes på forskellige punkter langs kurven i grafen itidligere afsnit. Reaktionshastigheden ved hvert punkt på denne kurve er direkteproportional til koncentrationen af phenolphthalein på det tidspunkt.
Rate = k(phenolphthalein)
fordi denne ligning er en eksperimentel lov, der beskriver reaktionshastigheden, kaldes den hastighedsloven for reaktionen. Proportionalitetskonstant, k, er kendt som hastighedskonstant.
Øvelsesproblem 2:
Beregn hastighedskonstanten for reaktionen mellem phenolphthalein og OH – ion, hvis den øjeblikkelige reaktionshastighed er 2.5 gange 10-5 mol per liter per sekund, når koncentrationen af phenolphthalein er 0,0025 M.
Klik her for at tjekke dit svar til praksis Problem 2.
Klik her for at se en løsning til praksis Problem 2.
Øvelsesproblem 3:
brug hastighedskonstanten for reaktionen mellem phenolphthalein og OH – ion til at beregne den indledende øjeblikkelige reaktionshastighed for de eksperimentelle data, der er anført i den foregående tabel.
Klik her for at tjekke dit svar til praksis Problem 3.
Klik her for at se en løsning til praksis Problem 3.
![]()
forskellige måder at udtrykke reaktionshastigheden
der er normalt mere end en måde at måle reaktionshastigheden på. Vikan studere nedbrydningen af hydrogeniodid, for eksempel ved at måle hastigheden påsom enten H2 eller I2 dannes i den følgende reaktion eller derat, hvor HI forbruges.
2 HI (g) H2(g) + I2(g)
eksperimentelt finder vi, at den hastighed, hvormed I2 dannes, erproportional til kvadratet af HI-koncentrationen til enhver tid.
![]()
Hvad ville der ske, hvis vi studerede den hastighed, hvormed H2 dannes?Den afbalancerede ligning antyder, at H2 og I2 skal dannes pånøjagtigt den samme hastighed.
![]()
Hvad ville der dog ske, hvis vi studerede den hastighed, hvormed HI forbrugesi denne reaktion? Fordi HI forbruges, skal ændringen i koncentrationen være anegativt tal. Ved konvention rapporteres reaktionshastigheden altid som en positivnummer. Vi er derfor nødt til at ændre tegnet, før vi rapporterer reaktionshastigheden for areactant, der forbruges i reaktionen.
![]()
det negative tegn gør to ting. Matematisk konverterer det en negativændring i koncentrationen af HI til en positiv sats. Fysisk minder det os om, atkoncentrationen af reaktanten falder med tiden.
Hvad er forholdet mellem reaktionshastigheden opnået vedovervågning af dannelsen af H2 eller I2 og den hastighed, der opnås ved at se HI forsvinde? Reaktionens støkiometri siger, at to HI-molekyler erforbruges for hvert molekyle af H2 eller i2 produceret. Dette betyder dethastigheden for nedbrydning af HI er dobbelt så hurtig som den hastighed, hvormed H2 og i2er dannet. Vi kan oversætte dette forhold til en matematisk ligning som følger.
![]()
som et resultat er hastighedskonstanten opnået ved at studere den hastighed, hvormed H2og I2 dannes i denne reaktion (k), ikke den samme somhastighedskonstanten opnået ved at overvåge den hastighed, hvormed HI forbruges (k’)
Øvelsesproblem 4:
Beregn den hastighed, hvormed HI forsvinder i den følgende reaktion i det øjeblik, hvor I2 dannes med en hastighed på 1,8 gange 10-6 mol pr.liter pr. sekund:
2 HI(g) ![]() H2(g) + I2(g)
H2(g) + I2(g)
Klik her for at kontrollere dit svar på Øvelsesproblem 4.
Klik her for at se en løsning til at øve Problem 4.
![]()
Satsloven Versus Støkiometri af areaktion
i 1930 ‘ erne studerede Sir Christopher Ingold og kolleger ved University ofLondon kinetikken for substitutionsreaktioner såsom følgende.
CH3Br(AK) + OH-(AK)
CH3OH(AK) + br-(ak)
de fandt, at hastigheden af denne reaktion er proportional tilkoncentrationer af begge reaktanter.
Rate = k(CH3Br) (OH-)
da de løb en lignende reaktion på en lidt anden startmateriale, de fik lignende produkter.
(CH3) 3CBR(AK) + OH-(AK)![]() (CH3) 3COH(AK) + Br-(AK)
(CH3) 3COH(AK) + Br-(AK)
men nu var reaktionshastigheden proportional med koncentrationen af kunen af reaktanterne.
Rate = k ((CH3)3cbr)
disse resultater illustrerer et vigtigt punkt: satsloven for areaktion kan ikke forudsiges ud fra reaktionens støkiometri; det skal bestemmeseksperimentelt. Nogle gange er satsloven i overensstemmelse med det, vi forventer afstoichiometri af reaktionen.
2 HI(g) H2(g) + I2(g)
Rate = k(HI)2
Often, however, it is not.
| 2 N2O5(g) |
Rate = k(n2o5) |
![]()
rækkefølge af molekylaritet
nogle reaktioner forekommer i et enkelt trin. Reaktionen, hvor et chlorineatom overføres fra ClNO2 til NO for at danne NO2 og ClNO, er et godt eksempel på en Et-trins reaktion.
ClNO2(g) + NO(g)
NO2(g) + ClNO(g)
Other reactions occur by a series of individual steps. N2O5,for example, decomposes to NO2 and O2 by a three-step mechanism.
| Step 1: | N2O5 |
||
| Trin 2: | NO2 + NO3 |
||
| trin 3: | no + No3 |
trinene i en reaktion klassificeres med hensyn til molekylaritet,som beskriver antallet af forbrugte molekyler. Når et enkeltmolekyle forbruges, kaldes trinnet unimolekylært. Når to molekyler erforbruges, er det bimolekylært.
Øvelsesproblem 5:
Bestem molekylæriteten af hvert trin i reaktionen, hvormed N2O5 nedbrydes til NO2 og O2.
Klik her for at tjekke dit svar til praksis Problem 5.
Klik her for at se en løsning til praksis Problem 5.
reaktioner kan også klassificeres efter deres rækkefølge. Dekomponeringen af N2O5 er en førsteordensreaktion, fordi reaktionsraten afhænger af koncentrationen af N2O5 hævet til den første effekt.
Rate = k (N2O5)
nedbrydningen af HI er en andenordens reaktion, fordi satsenaf reaktionen afhænger af koncentrationen af HI hævet til den anden effekt.
Rate = k(HI)2
Når reaktionshastigheden afhænger af mere end enreagent, klassificerer vi reaktionen med hensyn til rækkefølgen af hvert reagens.
Øvelsesproblem 6:
klassificer rækkefølgen af reaktionen mellem NO og O2 til dannelse af NO2:
2 NO(g) + O2(g)![]() 2 NO2(g)
2 NO2(g)
Antag følgende hastighedslov for denne reaktion:
Rate = k(NO)2(O2)
Klik her for at kontrollere dit svar til praksis Problem 6.
forskellen mellem molekylaritet og ordrenaf en reaktion er vigtig. Molekylæriteten af en reaktion eller et trin i en reaktion beskriver, hvad der sker på molekylært niveau. Rækkefølgen af en reaktion beskriver hvadsker på makroskopisk skala. Vi bestemmer rækkefølgen af en reaktion ved at se påprodukter af en reaktion vises eller reaktanterne forsvinder. Reaktionens molekylaritet er noget, vi udleder for at forklare disse eksperimentelle resultater.
![]()
Kollisionsteori Model for kemiske reaktioner
kollisionsteorimodellen for kemiske reaktioner kan bruges tilforklar de observerede hastighedslove for både et-trins og flertrins reaktioner. Denne model antager, at hastigheden af ethvert trin i en reaktion afhænger af hyppigheden af kollisioner mellem partiklerne involveret i dette trin.
figuren nedenfor giver et grundlag for at forstå implikationerne af kollisionsteorimodellen for enkle, Et-trins reaktioner, såsom følgende.
ClNO2(g) + NO(g)![]() NO2(g) + ClNO(g)
NO2(g) + ClNO(g)

den kinetiske molekylære teori antager, at antallet af kollisioner forfølger i en gas afhænger af antallet af partikler pr. Den hastighed, hvormed NO2 og ClNO dannes i denne reaktion, bør derfor være direkte proportional med koncentrationen af både ClNO2 og NO.
Rate = k(ClNO2)(NO)
kollisionsteorimodellen antyder, at hastigheden for ethvert trin i areaktion er proportional med koncentrationerne af de reagenser, der forbruges i dette trin. Therate lov for en Et-trins reaktion bør derfor være enig med støkiometri af thereaktion.
følgende reaktion forekommer for eksempel i et enkelt trin.
CH3Br(AK) + OH-(AK)![]() CH3OH(AK) + Br-(AK)
CH3OH(AK) + Br-(AK)
når disse molekyler kolliderer i den rigtige retning, kan et par ikke-bindende elektroner på OH – ion doneres til carbonatomet i midten af CH3Br molekylet, som vist i nedenstående figur.
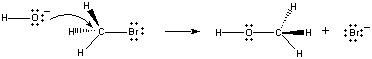
Når dette sker, dannes en kulstof-iltbinding på samme tid somcarbon-brombinding er brudt. Nettoresultatet af denne reaktion er substitutionen af anOH – ion med en Br – ion. Fordi reaktionen forekommer i en enkelttrin, som involverer kollisioner mellem de to reaktanter, er hastigheden af denne reaktion proportional med koncentrationen af begge reaktanter.
Rate = k(CH3Br) (OH-)
ikke alle reaktioner forekommer i et enkelt trin. Følgende reaktion forekommer itre trin, som vist i nedenstående figur.
(CH3)3CBR(AK) + OH-(AK)![]() (CH3)3COH(AK) + Br-(AK)
(CH3)3COH(AK) + Br-(AK)
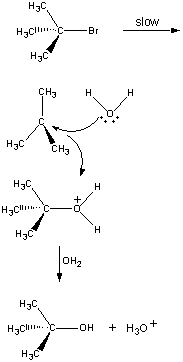
i det første trin, den (CH3)3CBR molekyledissocierer ind i et par ioner.
| første trin | 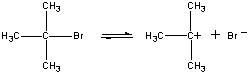 |
den positivt ladede (CH3)3C+ ion derefterreagerer med vand i et andet trin.
| andet trin | 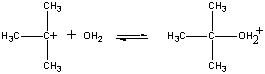 |
produktet af denne reaktion mister derefter en proton til enten Oh-ion eller vand i det sidste trin.
| tredje trin | 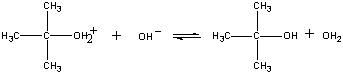 |
det andet og tredje trin i denne reaktion er meget hurtigere Endførst.
| (CH3)3CBr |
Slow step | |
| (CH3)3C+ + H2O |
Fast step | |
| (CH3)3COH2+ + OH- |
Fast step |
The overall rate of reaction is therefore more or less equal to the rateof the first step. Det første trin kaldes derfor det hastighedsbegrænsende trin iDenne reaktion, fordi det bogstaveligt begrænser den hastighed, hvormed reaktionsprodukterne kan dannes. Fordi kun et reagens er involveret i det hastighedsbegrænsende trin, er reaktionshastigheden proportional med koncentrationen af kun dette reagens.
Rate = k((CH3)3cbr)
satsloven for denne reaktion adskiller sig derfor fra det, vi villeforudsige fra reaktionens støkiometri. Selvom reaktionen forbruger begge (CH3)3CBRAND OH-, er reaktionshastigheden kun proportional med koncentrationen af(CH3) 3cbr.
satsloven for kemiske reaktioner kan forklares ved følgendegenerelle regler.
hastigheden af ethvert trin i en reaktion er direkte proportional med koncentrationerne af de reagenser, der forbruges i dette trin.
den samlede hastighedslov for en reaktion bestemmes af sekvensen af trin eller mekanismen, hvormed reaktanterne omdannes til reaktionsprodukterne.
den samlede hastighedslov for en reaktion domineres af hastighedsloven for det langsomste trin i reaktionen.