A Microbial Biorealm page on the genus Citrobacter freundii
Classification
Higher order taxa
Bacteria; Proteobacteria; Gammaproteobacteria; Enterobacteriales; Enterobacteriaceae; Citrobacter
Species
NCBI: Taxonomy
Citrobacter Freundii
Description and significance
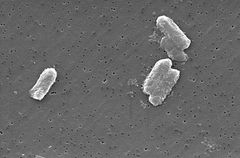 Photo: Pete Wardell/CDC
Photo: Pete Wardell/CDC
Citrobacter freundiiを含むCitrobacter種は、好気性グラム陰性桿菌である。 Citrobacter freundiiは長い棒状の細菌であり、典型的には長さが1-5μ mである。 ほとんどのc.freundii細胞は、移動するために使用される多くの鞭毛に囲まれているが、いくつかは非運動性である。 その生息地には、環境(土壌、水、下水)、食物、動物や人間の腸管が含まれています。 それは腸内細菌科の家族に属します。
日和見病原体として、C.freundiiは多くの重要な日和見感染症の原因となっています。 これは、気道、尿路、血液および患者の他のいくつかの通常は滅菌部位の様々な院内感染の原因であることが知られている。 C.freundiiはすべての日和見感染症の約29%を表しています。 したがって、C.freundiiゲノムの多くの異なる株とプラスミドが配列決定されている主な理由の一つは、これらの日和見感染と戦うことができる抗生物質
驚くべきことに、ヒトのこの感染性微生物は環境において積極的な役割を果たす。 C. freundiiは環境の亜硝酸塩に硝酸塩を減らすために責任があります。 この重要な変換は、窒素サイクルの重要な段階です。 地球の大気は約85%の窒素であるため、窒素のリサイクルは非常に不可欠です。 したがって、環境への重要な貢献のために、C.freundiiのゲノムを配列決定するためのもう一つの動機である。
シトロバクター属は、1932年にWerkmanとGillenによって発見されました。 C.freundiiの培養物を土壌抽出物から分離し,同じ年に同定した。
ゲノム構造
c.freundiiの完全なゲノムに関する情報は、微生物のいくつかの個々の株およびプラスミドが配列決定されているが、オンラインで入手 最も顕著なものはプラスミドpCTX-M#3であり、最大のプラスミドであり、大量のタンパク質をコードしているためである。 そのシーケンスは2005年1月6日に完了しました。 それは環状DNAプラスミドであり、89,468ヌクレオチド塩基対の長さである。 プラスミドの長さは0.089468(Mbp)である。 それは51.0%のGCの内容で構成され、105の蛋白質を符号化します。
Cのもう一つの重要な特徴。 freundiiゲノムは,L-メチオニンγ-リアーゼ(MGL)をコードするプラスミドを含む腸内細菌科の唯一の微生物である。 プラスミドの塩基配列は、3000bpの長さのEcoRIインサートを含む。 この断片には、2つの開いた読み取りフレームも含まれています。 最初のフレームは1,194ヌクレオチドで構成され、2番目のフレームは1,296ヌクレオチドで構成されています。MegL遺伝子として知られている最初のフレームは、異なるソースからのMglとの配列相同性を有する398アミノ酸残基のタンパク質をコードしています。 第二のフレームは、permeasesのファミリーに属するタンパク質との配列相同性を有するタンパク質をコードする。
C.freundii OS60AmpC β-ラクタマーゼ遺伝子も配列決定されており、1197ヌクレオチドから構成されている。 それは380アミノ酸の長い前駆物質を符号化し、5’端に19の残余のシグナルペプチドを含んでいます。 この遺伝子は、39 781ダルトンの分子量を有する成熟タンパク質をコードしている。 これらの前駆体中のアミノ酸位置は、大腸菌K12染色体AmpC β-ラクタマーゼ中の残基とsuprisinlgy同一である。
Cのゲノムにおけるもう一つの重要な株。 freuniiはGN346であり、これは1965年に回収された臨床分離株である。 この株は、アニビトイックスセファロスポリンおよびセファマイシンを加水分解し、不活性化する能力を有する酵素セファロスポリナーゼを産生する。 セファロスポリナーゼ遺伝子の構造およびプロモーター領域は、1408ヌクレオチドの長さである。 成熟した酵素のアミノ酸配列は、361アミノ酸で構成され、分子量は39,878Daである。
細胞構造と代謝
C.freundiの細胞構造は長く、通常は長さが1-5μ mの棒状である。 細胞の外側には、motalityのために使用される多くの鞭毛が含まれています。 C.freundiiはグラム陰性菌であるため、2つの膜(内側と外側)が含まれています。ペリプラズム空間は、2つの膜の間にある。 外の膜はエネルギー源を含んでいません;しかしそれはその助けの内で埋め込まれる多くのporinsを有機体が重要なイオンを得るのを含んでいます。 グラム陽性菌とは異なり、c.freundii細胞はペプチドグリカンで構成される厚い細胞壁を含まない。
代謝のために、C.freundiiは唯一の炭素とエネルギー源としてグリセロールで成長する驚くべき能力を持っています。 このプロセスでは、グリセロールはdismutationプロセスによって発酵されます。 このプロセスには2つの経路が必要です。 最初の経路では、グリセロールはNAD1結合グリセロールデヒドロゲナーゼによってジヒドロキシアセトンに脱水素される。 その後、ジヒドロキシアセトンはリン酸化され、ジヒドロキシアセトンキナーゼによって解糖に漏斗状になる。 第二の経路では、グリセロールは補酵素B12依存性グリセロールデヒドラターゼによって脱水され、3-ヒドロキシプロピオンアルデヒドを形成する。 この生成物は、NADH結合1,3-プロパンジオールデヒドロゲナーゼによって主要な発酵生成物1,3-プロパンジオールに還元され、NAD1を再生する。 Dhaレギュロンは、これら2つの経路の4つの必須酵素をコードしています。 驚くべきことに、dhaレギュロンの発現は、グリセロールが存在する場合にのみ誘導される。
c.freundiiの細胞はまた、炭素源として乳糖またはクエン酸塩を代謝することができる。
生態学
Citrobacter freundiiは、一般的に土壌、水、および下水道を中心に、環境で発見されています。 それらは水の潜在的な汚染の指標です。 彼らはまた、哺乳類、鳥類、爬虫類、両生類を含む病気の動物のさまざまな器官にも見られます。 彼らは他のorganimsと相互作用することが知られていません。
環境では、C.freundiiは硝酸塩またはアンモニウムイオン(四つの水素原子と結合した窒素原子である)を亜硝酸塩に変換することができ、この反応は、環境内だけでなく、人間や他の動物の消化管内でも起こる。 環境中で硝酸塩を亜硝酸塩に変換した後、亜硝酸塩は窒素に変換され、この最終ステップは85%の窒素で構成される地球の大気中の窒素サイクルを完 この生物の生態学的役割は、リン酸錯体を構築することによって(核技術の基礎材料である)ウランを蓄積することができるため、窒素サイクルにおける重要な役割を含むだけでなく。
Citrobacter freundiiはまた、tannerysで使用されるタンニン酸の生分解のために研究されています。日和見病原体として、Citrobacter freundiiはしばしば重要な日和見感染の原因であり、健康なヒトの宿主には一般的に病気を引き起こさないことを意味する。
Pathology
彼らは弱い免疫系を持つ患者にのみ影響を与え、その人に感染する”機会”が必要であることを意味します。 したがって、抑制された免疫系を有する患者では、シトロバクター種は、気道、尿路、および血液の多種多様な院内感染を引き起こすことが知られている。 肝疾患、胆道疾患および膵臓疾患は、C.freundiiによって引き起こされる一般的な疾患でもある。 胆道は、c.freundii桿菌による感染の最も一般的な部位である。
C.freundiiが関連している致命的な病気の一つは、新生児髄膜炎です。 新生児髄膜炎は、細菌の侵入による髄膜(中枢神経系を取り囲む膜の系)の炎症である。 シトロバクター髄膜炎の死亡率は許容できないほど高く、患者の死亡率は25-50%である。 さらに、深刻な神経学的問題は、生存者の75%に依然として持続する。 この疾患では、citrobacter freundiiは、脈絡叢上皮および脳毛細血管内皮からなる血液脳関門に浸透することができる。 Badger etによって実行されたテスト。
“Citrobacter freundiiがヒトの脳微小血管内皮細胞に侵入し、複製する”という記事のalは、C.freundiiの細菌増殖が細胞内レベルで起こることを示唆しており、これは一般的な科学的思想に反していた。 C.freundiiは液胞を横断し,複製し,血液脳関門を横断するためにヒト脳微小血管内皮細胞(HBMEC)の基底外側に放出されることを示した。 さらなる分析は、潜在的に感染症を治療するための治療戦略を可能にする可能性があります。 利用可能な治療法はまだありません。
マスおよびcyprinidsで研究されている特定の病気は、C.freundiiによっても引き起こされます。 C.freundiiは、トラウトの腸における異常な炎症性変化およびシプリニドの内臓における炎症性および壊死性変化を引き起こす。 この病気は、C.freundiiの純粋な培養による人工感染によって発見された。 この発見は、魚の病気の原因としてC.freundiiを確立しました。
Journal Of Medical Microbiologyによるケーススタディでは、患者は珍しいCitrobacter freundiiによる腹膜炎およびトンネル感染を発症した。 患者は連続外来腹膜透析を受けていた。 通常、原因となる薬剤は、グラム陽性微生物、特に黄色ブドウ球菌およびブドウ球菌edpidermisである。 また、c.freundiiによるトンネル感染の既知の報告はない。 最初の抗生物質療法は機能せず、カテーテルが除去されるまで感染は持続し続けた。 Citrobacter Freundiiは、最初の治療が成功しなかった理由である異なる抗生物質感受性を示すので、これは臨床的に重要です。 カテーテルが除去されるまで、患者は治療に応答しなかったCitrobacter freundiiは入院患者および免疫不全患者に影響を与える日和見病原体であることを示した。
バイオテクノロジーへの応用
バイオテクノロジー業界では、Citrobacter freundiiは多くの重要な酵素を生産しています。それが生成する最初の酵素はホスファターゼである。 Cのホスファターゼ活性。 freundiiは、バイオテクノロジー産業において重要な役割を果たすことができる鉛の蓄積に関与していると仮定されている。 C.freundiiのホスファターゼ活性はまた、いくつかの診断試薬に対する耐性を有することが発見されている。
L-セレノシステインのL-アラニンへの切断を特異的に触媒する酵素である細菌セレノシステインベータリアーゼの精製と特性評価は、Citrobacter freundiiから精製され この酵素は分子量caの単量体である。 64,000および酵素のmolごとの補因子としてピリドキサール5’リン酸塩の1molを含んでいます。 この酵素はまた、Β-クロロ-L-アラニンのα、β除去を触媒してNH3、ピルビン酸塩を形成する。
C.Freundii株はまた、クラス1AmpCセファロスポリナーゼをコードするプラスミドを運ぶ。 これらの酵素は、新しいセファマイシンおよびセファロスポリンを不活性化する加水分解することができる。
現在の研究
C.freundiiの特定の株に関する小規模な研究は、テネシー大学、ノックスビルで最近行われました。 Cにおける特定のテトラサイクリンおよびストレプトマイシン耐性遺伝子およびクラス1インテグロンの重要性 酪農土壌および非酪農土壌から単離したfreundiiを評価した。 酪農場の土壌から抽出されたC.freundiiの一つの株は、異なる挿入された遺伝子カセットとクラス1インテグロンを運んだ。 この小さな研究の結果は、酪農場の土壌中のC.freundiiにおける複数の耐性遺伝子とクラス1インテグロンの存在は、抗菌耐性遺伝子の貯水池として作用し、土壌中の他の共生および先住民族の微生物群集へのこれらの抗菌耐性遺伝子の普及に役割を果たす可能性があることを示唆した。 しかし、この仮説を支持するためには、より多くの場所で実施された追加の長期的な研究が必要である。
C.freundiiに関する第二の研究は、特定のプライマーの三対を同時に使用して特定の微生物(C.freundiiを含む)の遺伝子を検出するポリメラーゼ連鎖反応(PCR)法を考案す この方法には、SPVC-1およびSPVC-2、INVA-1およびINVA-2、およびVIAB-1およびVIAB-2の三つのプライマー対の設計が含まれていた。 PCRは、14臨床的に重要な細菌生物を同定するために、これらの三つのプライマーを使用して行われました。 以下の株は、PCRを使用して迅速に同定された:(1)C.freundii;(2)S.Typhi;およびS.Paratyphi C;(3)S.Dublin(病原性抗原陽性);および(4)Spv型病原性プラスミドを有するSalmonella serovars。 このPCR法は新しいものであるが,将来の技術の進歩により,哺乳動物におけるc.freundiiの同定を直ちに可能にし,適切な抗生物質治療を遅滞なく開始できるようにすることができる。
C.freundiiに関する第三の研究は、バルセロナ、スペインの大学で行われました。 二つのCitrobacterfreundii株におけるフルオロキノロンに対する耐性のメカニズムを調べた。 両方の株は同じ患者から単離された。 この研究は、この微生物のacrAおよびacrB遺伝子の部分的な特性評価を可能にした。 両株における遺伝子の発現を大腸菌のDNAマイクロアレイを用いて解析した。 C.freundiiと大腸菌の部分的に配列されたacrAとacrB遺伝子の間のヌクレオチド類似性は、それぞれ80.7%と85%であった。 C.freundiiのacra遺伝子とacrb遺伝子はEの遺伝子と類似している。 大腸菌とそれらの過剰発現は、フルオロキノロンの最終的な最小阻害濃度を調節する上で重要な役割を果たしている可能性があります。
C.freundiiに関する第四の研究は、台湾で行われました。 研究者のチームは、海洋動物によって誘発された傷害からC.freundiiによって引き起こされた壊死性筋膜炎を発症した糖尿病患者を単離した。 壊死性筋膜炎は、皮膚および皮下組織のより深い層内の感染症である。 患者を治療するとき、彼らは創傷内の液体からサンプルを採取し、C.freundiiを発見した。 セフォタクスミンとセフェプミンによる抗生物質治療を開始した三日後,皮下膿ようの蓄積があった。 患者への傾向の6、10、14、および21日後に、いくつかの抗生物質は、患者にいくつかの救済を与えていたが、長期的な回復に達していませんでした。 Cefotoaxime、cefepime、ciprofloxaminはC.freundiiのためのマッチではなかった抗生物質間にあります。 患者はエルタペネム治療の42日後に完全に回復した。 研究者らは、互いに5日以内にC.freundiiの二つのコロニーを単離していた。 分離株が成長するにつれて、それらはセフォタキシムおよびセフェピムに対して非常に耐性になった。 EntrapenemがC.freundiiに対して働いた理由は、AmpC産生腸内細菌科に対して活性であるためである。
抗生物質耐性
シトロバクター種は、長期の病院治療を受けている患者に関連する院内感染の一般的な原因です。 C.freundiiは最近,ピペラシリン,ピペラシリンタゾバクタム,バンコマイシンおよびセファロスポリンを含む広域スペクトル抗ビオチンに対する耐性を発現することが報告されている。 セフトリアキソン耐性シトロバクター freundii(CRCF)の単離は、過剰に処方された広域スペクトル抗生物質と関連付けられています。 新たなCRCF株は、抵抗性遺伝子の誘導または抑制、ならびに競合生物の排除を示唆する可能性がある。 CRCFは、主にAIDS、末梢血管疾患、および脳血管疾患を含む有意な併存疾患を有する患者から単離されている。 Fluoroquinoloneの使用法はまたCRCFの分離に対して影響をもたらさないために報告されました。
Citrobacter freundiiはまた、その染色体にセファロスポリナーゼをコードする遺伝子を含むことが知られている。 この酵素は、セファロスポリンおよびセファミシスのラクタム環中のCO−NH−結合を加水分解し、細菌をこのタイプの抗生物質に耐性にする。 しかし,新しい第三世代セフェムおよびセルバペネムに曝されたとき,臨床的に単離されたC.freundiiはこれらの物質に対して感受性を示した。名古屋大学病院外科病棟において,第三世代セフェムに耐性のあるC.freundiiの小さな発生が観察されている。 患者の胆汁,創傷ガーゼ,糞便,膿および腹水からC.freundiiを単離した。 これらの新しいC.freundii株にはAmpcセルファロスポリナーゼをコードするプラスミドが含まれていることが示唆されたが,c.freundiiからE.coliへのセフェム抵抗性の伝達に失敗すると,この酵素はC.freundiiの染色体にコードされている必要があると結論した。 C.freundiは院内感染に関連しているため、この新しい株に注意することが推奨されます。
1. 王JT、チャンSC、陳YC、Luh KT。 “Citrobacter freundiiの抗菌感受性の比較は、二つの異なる期間で分離します。”微生物学、免疫学および感染のジャーナル。 2000Dec;33(4):258-62.
2. ホレンJG、マリー TW、エンルギッシュJC3rd。 “免疫担当患者における自発的なCitrobacter freundii感染。”皮膚科のアーカイブ。 2007Jan;143(1):124-5.
3. プチェンコヴァSG. クリミア沿岸に沿って水の地域で”腸内細菌。”Mikrobiolohichnyş zhurnal。 1996Mar-Apr;58(2):3-7.
4.http://www.ncbi.nlm.nih.gov/sites/entrez?db=genomeprj&cmd=Retrieve&dopt=Overview&list_uids=13123
5. Ilya V.Manukhov,Daria V.Mamaeva,Sergei M. Rastorguev、Nicolai G.Faleev、Elena A.Morozova、Tatyana V.Demidkina、およびGennadii B.Zavilgelsky。 “L-メチオニンγ-リアーゼをコードする遺伝子は、腸内細菌科ファミリーゲノムに存在する:Citrobacter freundii L-メチオニンγ-リアーゼの同定と特性評価。”細菌学のジャーナル。 2005June;187(11):3889-3893.
6. リンドバーグ、フレデリック、ウェストマン、レナート、ノーマーク、スタファン。 “Citrobacter freundii ampC β-ラクタマーゼ誘導における規制成分。”アメリカ合衆国の国立科学アカデミーの議事録。 1985July;82(14):4620-4624.
7. 塚本K,橘K,山崎N,石井Y,氏家K,西田N,澤井T.”Citrobacter freundii GN346からのクラスC β-ラクタマーゼの活性部位におけるリジン-67の役割。”欧州生化学ジャーナル/FEBS。 1990Feb22;188(1):15-22.
8. キービル、ホフ、コール-ジャ… “Citrobacter freundiiの原栄養成長と通気培地での見かけの成長要件の生化学的基礎。”一般微生物学のジャーナル。 1997Jan;98(1):273-6.
9. マルコ-サンチェスF、トゥラビアン-フェルナンデスJL、デュラン-ペレス-ナバロA。 “致命的なCitrobacter Freundii気管支肺炎は妥協のない患者でコミュニティで取得しました。”Revista Clínica Española. 1985Apr;176(6):320
10. ジュリー-L-アナグマ、モニーク-F-スティンズ、グァンシク-キム。 “Citrobacter freundiiは、ヒトの脳微小血管内皮細胞に侵入し、複製する。”ひにょきかきよ。 “Acta Urologica Japonica” 1985Jul;31(7):1159-70.
11. Drelichman V,Band JD. “Citrobacter diversusとCitrobacter freundiiによるBacteremias。 発生率、危険率および臨床転帰。”内科のアーカイブ。 1985Oct;145(10):1808-10.
12. Srinivasan V,Nam HM,Sawant AA,Headrick SI,Nguyen LT,Oliver SP. “酪農および非酪農農場土壌から単離された腸内細菌科におけるテトラサイクリンおよびストレプトマイシン耐性遺伝子およびクラス1インテグロンの分布。”微生物生態学。 2007年8月15日。
13. Sánchez-Céspedes J,Vila J.”二つのCitrobacter freundii臨床分離株におけるacrAB遺伝子座の部分的な特性評価。”抗菌剤の国際ジャーナル。 2007Sep;30(3):259-63.
14. Cişerci IH,Korcan SE,Konuk M,Oztürk S. “シトロバクター株とシュードモナス株のALAD活性とPb汚染のバイオマーカーとしての使用法の比較。”環境モニタリングと評価。 2007年(平成22年)に発売された。
15. Chocat P,Esaki N,Tanizawa K,Nakamura K,Tanaka H,Soda K.”Citrobacter freundiiからのセレノシステインベータリアーゼの精製とキャラクタリゼーション。”細菌学のジャーナル。 1985Aug;163(2):669-76.
16. ヒレル-S-レヴィンソン、インガ-マーラー。 “Citrobacter freundiiおよび黄色ブドウ球菌におけるホスファターゼ活性および鉛耐性。”FEMS”(エフエムフーズ)は、日本の音楽ユニット。 1998Apr;161(1):135-138.
17. 村上K,吉田T.”citrobacter freundiiのセファロスポリナーゼに対するモキサラクタムの共有結合。”抗菌剤および化学療法。 1985May;27(5):727-32.
18. Dervisoglu,E.,Yegenaga,I.,Yumuk,Z.”Citrobacter Freundii腹膜炎および連続外来腹膜透析患者におけるトンネル感染。”医学微生物学のジャーナル、2008。 第57巻 125-127頁
19. キムPW、ハリスAD、Roghmann MC、モリスJG Jr、Strinivasan A、Perencevich EN。 “入院患者におけるセフトリアキソン耐性対感受性シトロバクター freundiiの単離のための疫学的危険因子”Antimicrob Agents Chemother,2003Sep;47(9):p.2882-2887.
20. 灘T,馬場H,川村K,大倉T,鳥居K,太田M.”外科病棟における第三世代セフェム耐性citrobacter freundii感染の小さな発生”Jpn J Infect Dis. 2004Aug;57(4):p.181-182.
21. Chuang,Y.,Tseng,S.,Teng,L.,Ho,Y.,And Hsueh,P. “Citrobactor freundiiにおけるセフォタキシム抵抗性の出現は、壊死性筋膜炎および骨髄炎を引き起こす”感染のジャーナル、2006。 第53巻 p.e161-e163。
22.Badger,J.,Stins,M.,およびSik Kim,K.”Citrobacter freundii Invades and Replicates in Human Brain Microvascular Endothelial Cells”Infection and Immunity,1999. 第67巻 P.4208-4215。
Sumaira Akbarzada、レイチェル-ラーセンの学生によって編集グレッグ-バルガスとダレン-ジェン、M Glogowskiat Loyola大学の学生Gergana GrigorovaとMichal Olszewski、M Glogowskiat Loyola大学の学生Alex KulaとJoanna Aiken、M Glogowskiat Loyola大学の学生によって編集