Dos de las herramientas genéticas más emocionantes y versátiles diseñadas en los últimos 30 años son las tecnologías Cre-lox y FLP-FRT. Ambos permiten que la ubicación y el momento de la expresión génica se regulen de cerca. Este artículo describe brevemente cómo funcionan los dos sistemas y cómo se pueden usar en modelos de ratón.
El sistema Cre-lox
La tecnología Cre-lox se introdujo en la década de 1980 (Sauer y Henderson 1988; Sternberg y Hamilton 1981) y fue patentada por DuPont Pharmaceuticals. Se ha aplicado con éxito en levaduras, plantas, cultivos celulares de mamíferos y ratones (Araki et al. 1987). Se basa en la capacidad del gen de recombinasa de ciclación bacteriófaga P1 (Cre) para efectuar la recombinación entre pares de sitios de loxP. Dicha recombinación en un ratón» Cre-lox » (ver más abajo) puede activar o inactivar un gen de interés.
Para usar la tecnología Cre-lox, un investigador tiene que producir un ratón Cre-lox, típicamente criando un ratón Cre a un ratón loxP. Un ratón Cre contiene un transgén recombinasa Cre bajo la dirección de un promotor específico de tejido; un ratón loxP contiene dos sitios loxP que flanquean un segmento genómico de interés, el locus «floxeado». Por lo general, los ratones Cre y loxP se producen mediante el uso de tecnología transgénica (Nagy 2000). Dependiendo de los promotores y otros controles reglamentarios utilizados para construirlos, los ratones Cre pueden diseñarse para expresar la recombinasa Cre solo bajo ciertas condiciones, incluidas las siguientes: en ciertos tejidos, cuando la dieta de un ratón se complementa con sustancias como doxiciclina, tetraciclina, RU486 y tamoxifeno (Brocard et al. 1998; Kellendonk et al. 1999; Utomo et al. 1999) y durante ciertas etapas de desarrollo.
Dependiendo de la ubicación y orientación de los sitios loxP en un ratón Cre-lox, la recombinasa Cre puede iniciar deleciones, inversiones y translocaciones del locus floxeado (Nagy 2000) (Fig. 1).
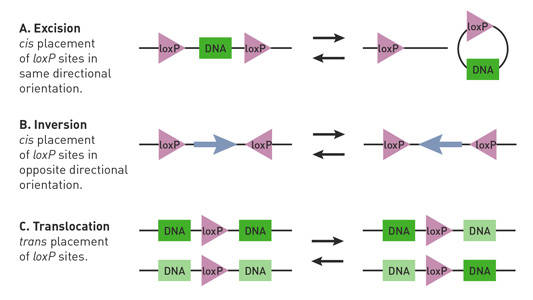 Fig. 1.Las reacciones de Cre-lox se ven afectadas por la orientación y ubicación de los sitios de loxP. Los sitios loxP pareados (triángulos) tienen direccionalidad y pueden colocarse en una disposición cis (misma hebra de ADN) o trans (diferentes hebras de ADN). A) Si los sitios de loxP flanquean un segmento de ADN (rectángulo) en una disposición cis y están orientados en la misma dirección, la recombinasa Cre media la escisión o la circularización del segmento. (B) Si los sitios loxP flanquean el segmento de ADN en una disposición cis y están orientados en direcciones opuestas, la recombinasa Cre media la inversión del segmento. (C) Si los sitios de loxP están ubicados en diferentes hebras de ADN y están orientados en la misma dirección, la recombinasa Cre media una translocación del segmento.
Fig. 1.Las reacciones de Cre-lox se ven afectadas por la orientación y ubicación de los sitios de loxP. Los sitios loxP pareados (triángulos) tienen direccionalidad y pueden colocarse en una disposición cis (misma hebra de ADN) o trans (diferentes hebras de ADN). A) Si los sitios de loxP flanquean un segmento de ADN (rectángulo) en una disposición cis y están orientados en la misma dirección, la recombinasa Cre media la escisión o la circularización del segmento. (B) Si los sitios loxP flanquean el segmento de ADN en una disposición cis y están orientados en direcciones opuestas, la recombinasa Cre media la inversión del segmento. (C) Si los sitios de loxP están ubicados en diferentes hebras de ADN y están orientados en la misma dirección, la recombinasa Cre media una translocación del segmento.
Por lo general, las cepas Cre y loxP se desarrollan de forma independiente y luego se cruzan. Muchas cepas Cre diferentes, cada una de las cuales contiene un transgén Cre bajo la dirección de un promotor específico de tejido diferente, pueden cruzarse con una sola cepa loxP. Dependiendo de qué cepas se aparean, se pueden construir una variedad de sistemas modelo mediados por Cre, incluidos transgénicos, knockouts, hipomorfos, hipomorfos reparables, aberrantes cromosómicos y mutantes inducidos por la dieta. En efecto, al mezclar y emparejar cepas Cre y loxP, un investigador puede estudiar los efectos de un gen en formas específicas del tejido y de la etapa de desarrollo que antes eran imposibles.
El sistema FLP-FRT
El sistema FLP-FRT es similar al sistema Cre-lox y se está utilizando con más frecuencia en la investigación basada en ratones. Implica el uso de flippasa (FLP) recombinasa, derivada de la levadura Saccharomyces cerevisiae (Sadowski 1995). El FLP reconoce un par de secuencias objetivo de recombinasa (FRT) del FLP que flanquean una región genómica de interés.
Araki K, Imaizumi T, Okuyama K, Oike Y, Yamamura K. 1997. Eficiencia de la recombinación por expresión transitoria de Cre en células madre embrionarias: comparación de varios promotores. J Biochem (Tokio) 122: 977-82.
Brocard J, Feil R, Chambon P, Metzger D. 1998 Una Cre recombinasa quimérica inducible por ligandos sintéticos, pero no naturales del receptor glucocorticoide. Nucleic Acids Res 26: 4086-90.
NOTAS DE JAX. 1999. NIH, Jackson Laboratory y DuPont Pharmaceuticals firman acuerdos de uso de tecnología Cre-lox. JAX NOTES 476: 4.Kellendonk C, Tronche F, Reichardt HM, Schutz G. 1999. Mutagénesis del receptor glucocorticoide en ratones. J Steroid Biochem Mol Biol 69: 253-9.
Nagy A. 2000. Cre recombinase: el reactivo universal para la adaptación del genoma. Génesis 26:99-109.
Sadowski P. 1995. Recombinasa Flp del plásmido de 2 µm de Saccharomyces cerevisiae. Prog Nucleic Acid Res Mol Biol 51: 53-91.Sauer B, Henderson N. 1988. Recombinación de ADN de sitio específico en células de mamíferos por la recombinasa Cre del bacteriófago P1. Proc Natl Acad Sci U S A 85: 5166-70.Sternberg N, Hamilton D. 1981. Recombinación específica del sitio del bacteriófago P1. I. Recombinación entre sitios de loxP. J Mol Biol 150: 467-86.Utomo AR, Nikitin AY, Lee WH. 1999. Control temporal, espacial y específico de tipo celular de la recombinación de ADN mediada por Cre en ratones transgénicos. Nat Biotechnol 17: 1091-6.