Dipoler
for å forstå arten av ikke-kovalente interaksjoner, må vi først gå tilbake til kovalente bindinger og dykke inn i emnet dipoler. Mange av de kovalente bindingene vi har sett-mellom to karboner, for eksempel, eller mellom et karbon og et hydrogen –involverer omtrent like stor deling av elektroner mellom de to atomer i bindingen. I disse eksemplene har de to atomene omtrent samme elektronegativitet. Husk fra ditt generelle kjemikurs at elektronegativitet refererer til » kraften til et atom i et molekyl for å tiltrekke seg elektroner til seg selv «(Dette er definisjonen som Tilbys Av Linus Pauling, Den fremtredende Amerikanske kjemikeren fra det 20. århundre som primært var ansvarlig for å utvikle mange av bindingskonseptene vi har lært).Men ganske ofte i organisk kjemi håndterer vi kovalente bindinger mellom to atomer med forskjellige elektronegativiteter, og i disse tilfellene er deling av elektroner ikke lik: jo mer elektronegative kjernen trekker de to elektronene nærmere. I karbon-oksygenbindingen av en alkohol, for eksempel, holdes de to elektronene i sigma-bindingen nærmere oksygenet enn de er til karbonet, fordi oksygen er betydelig mer elektronegativ enn karbon. Det samme gjelder for oksygen-hydrogenbindingen, da hydrogen er litt mindre elektronegativ enn karbon, og mye mindre elektronegativ enn oksygen.
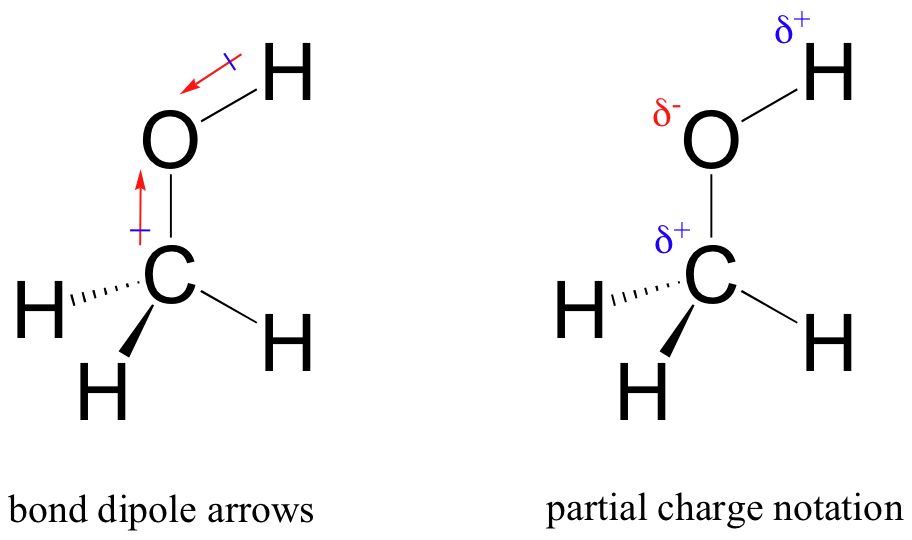
resultatet av denne ulik deling er det vi kaller en obligasjonsdipol, som eksisterer i en polar kovalent binding. En obligasjonsdipol har både negative og positive ender, eller poler, hvor elektrontettheten er lavere (den positive polen) og høyere (den negative polen). Forskjellen i elektrontetthet kan uttrykkes ved hjelp av den greske bokstaven delta for å betegne ‘delvis positiv’ og ‘delvis negativ’ ladning på atomene. ‘Dipolpiler’, med et positivt tegn på halen, brukes også til å indikere dipolens negative (høyere elektrondensitet) retning.
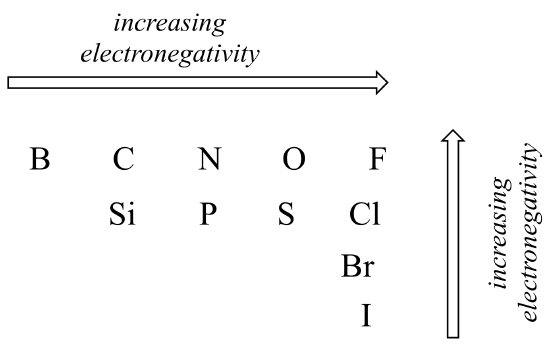
graden av polaritet i en kovalent binding avhenger av forskjellen i elektronegativitet mellom de to atomer. Elektronegativitet er en periodisk trend: den øker fra venstre til høyre over en rad av elementets periodiske tabell, og øker også når vi beveger oss opp i en kolonne. Derfor er oksygen mer elektronegativ enn nitrogen, som igjen er mer elektronegativ enn karbon. Oksygen er også mer elektronegativ enn svovel. Fluor, i øverste høyre hjørne av det periodiske bordet, er den mest elektronegative av elementene. Hydrogen er litt mindre elektronegativ enn karbon.
Periodiske trender i elektronegativitet
Øvelse 2.26
rasjonalisere de periodiske trender i elektronegativitet. Hvorfor øker det fra venstre til høyre, og reduseres fra topp til bunn? Dette er et godt spørsmål å snakke med klassekamerater og en instruktør eller veileder.
løsninger på øvelser
de fleste molekyler inneholder både polare og ikke-polare kovalente bindinger. Avhengig av plasseringen av polare bindinger og bindingsgeometri, kan molekyler ha en nettopolaritet, kalt et molekylært dipolmoment. Vann, som du sikkert husker, har et dipolmoment som skyldes de kombinerte dipolene av sine to oksygen-hydrogenbindinger. Fluorometan har også et dipolmoment.
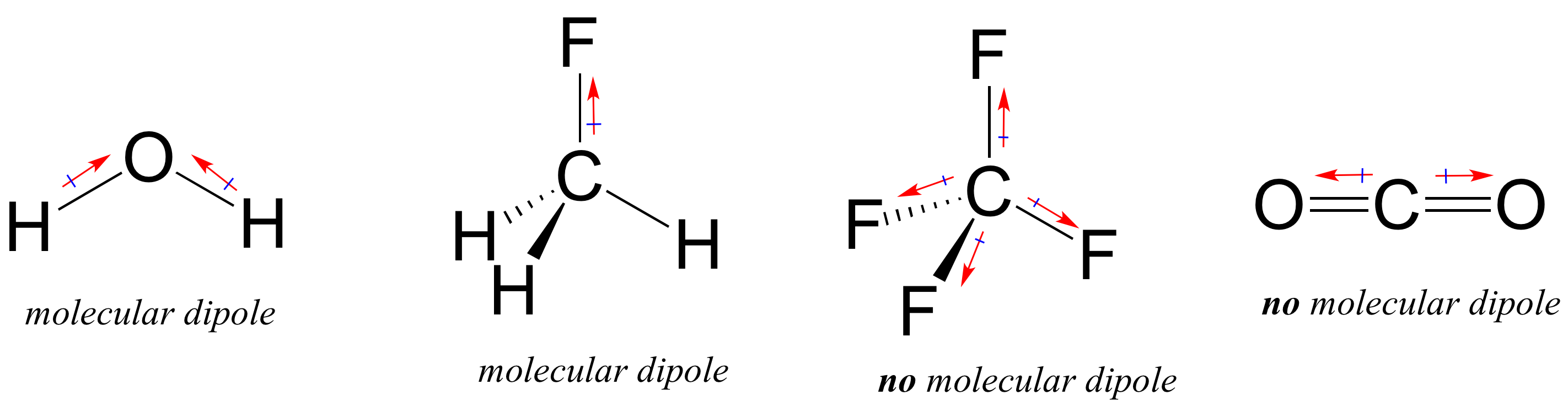
Tetrafluormetan har imidlertid fire polare bindinger som trekker like inn i de fire hjørnene av et tetahedron, noe som betyr at selv om det er fire bindingsdipoler, er det ikke noe samlet molekylært dipolmoment. Kullsyre mangler også et molekylært dipolmoment.
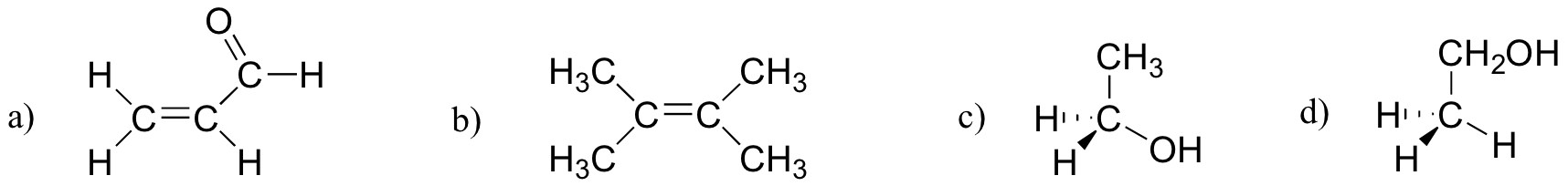
Øvelse 2.27
Hvilke av molekylene nedenfor har molekylære dipolmomenter?
Løsninger på øvelser