Fakta, Sammendrag & Definisjon
- En addukt er et produkt dannet av en addisjonsreaksjon
- Addukter kan bare dannes fra reaktanter som har flere bindinger, slik som alkener og karbonylgrupper
- Addukter kan dannes gjennom to typer addisjonsreaksjoner. reaksjon: elektrofil Og Nukleofil
- addukter dannes ofte mellom lewis syrer og lewis baser
hva er en addukt?
en addukt er et produkt dannet ved slutten av en addisjonsreaksjon. Dette er en reaksjon der to eller flere molekyler reagerer og kombineres for å danne et større produkt. Denne typen reaksjon kan bare forekomme mellom kjemiske forbindelser som har flere bindinger-forbindelser som alkener (dobbeltbindinger) og alkyner (trippelbindinger). Karbonyl (C=O) og imin (C=N) grupper kan også gjennomgå addisjonsreaksjoner, og dermed danne addukter.
hvordan dannes addukter?
som nevnt tidligere dannes addukter gjennom tilleggsreaksjoner. I denne typen reaksjon bryter dobbeltbindingen delvis når et reagerende molekyl angriper og legger til. Reaksjonen nedenfor viser en addisjonsreaksjon mellom eten og brom.

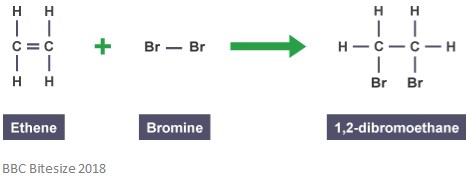
addukt i denne reaksjonen er 1,2-dibromoetan. Dette er fordi det er en distinkt art som inneholder alle atomer av alle komponentene.
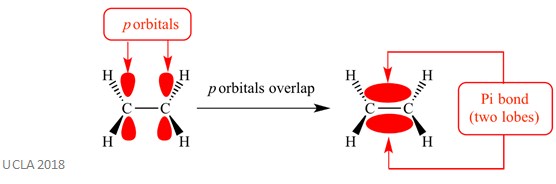
disse tilleggsreaksjonene involverer vanligvis pi (π) – obligasjoner. Dette er en kompleks type binding der p-orbitaler på tilstøtende atomer overlapper-det er denne overlappingen som forårsaker pi-bindingen. Dette skjer vinkelrett på noen sigma bindinger mellom de to samme atomer. Denne pi-bindingen har også to orbitale lober-en er over planet av sigma-bindingen, og den andre er under planet av sigma-bindingen. Pi-bindingen er vist i diagrammet nedenfor.

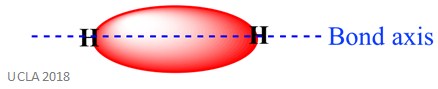
den samme reaksjonen kan også innebære sigma-obligasjoner. Dette er en type kovalent bindingsform ved overlapping av atomorbitaler langs bindingsaksen-med andre ord langs linjen som forbinder de to bundne atomer. For eksempel dannes sigma – bindingen i et hydrogenatom ved overlapping av to 1s orbitaler-en fra hvert hydrogenatom. Dette er bedre vist på bildet nedenfor – det røde området viste sigma bond.

det er to hovedtyper av addisjonsreaksjon: elektrofil addisjon og nukleofil addisjon.
Elektrofil Addisjon
en elektrofil addisjonsreaksjon er en type reaksjon der en binding brytes, og to nye bindinger dannes. Som diskutert tidligere, må reaktanten ha en dobbel eller trippelbinding-elektrofilen legger til en pi-binding i dette tilfellet. Dette er en tilleggsreaksjon, og så går ingenting tapt i prosessen-alle atomene som finnes i reaktantmolekylene finnes også i addukt.

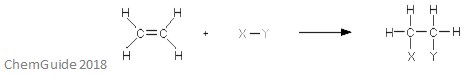
bildet ovenfor viser grunnlaget for en elektrofil addisjonsreaksjon. Som du kan se, er alle atomene i reaktantene funnet i adduct.En nukleofil addisjonsreaksjon er en type reaksjon der en dobbeltbinding brytes, og to enkeltbindinger dannes. En elektron-mangelfull (elektrofil) dobbelt – eller trippelbinding reagerer med noe som er elektronrikt (nukleofil). Nukleofilen legger til en pi-binding i dette tilfellet. Et eksempel på en nukleofil addisjonsreaksjon er vist nedenfor.

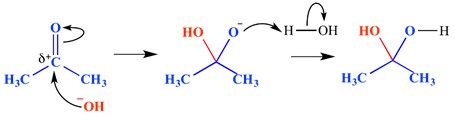
i dette eksemplet har et hydroksidion tilført karbonylgruppens delta – positive ende-dette har dannet et oksyanionisk tetrahedral mellommolekyl. Sluttresultatet er derfor tilsetningen av vann over karbonylgruppen pi-bindingen.
Lewis syrer og lewis baser
Addukter er ofte kjent for å danne Mellom Lewis syrer og Lewis baser. Molekylet som dannes kalles En Lewis syre-base addukt (Eller Et Lewis syre-base kompleks). Da addukter bare dannes gjennom tilleggsreaksjoner (det vil si uten samtidig tap av en gruppe), Kan Lewis-syre-og Lewis-basereaksjoner ikke være substitusjonsreaksjoner.
et godt eksempel på dette er reaksjonen MELLOM THF OG BH3,som er vist på bildet nedenfor. Som du vil se, Er Disse Lewis syre-Lewis base adducts vist med prikker – disse representerer elektroner.

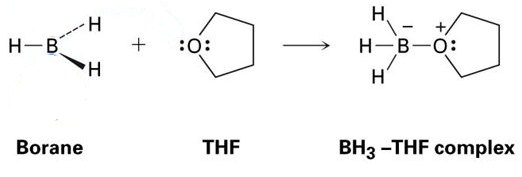
SOM du kan se, ER DET eneste produktet SOM dannes bh3-THF-komplekset, noe som betyr at det er en addukt.
Disse typer reaksjoner kan også avbildes med piler – disse pilene representerer donasjon av elektroner fra basen til syren. Den samme reaksjonen er vist nedenfor, men med piler for å indikere elektrondonasjon.

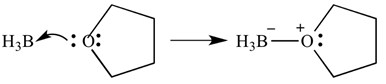
det er viktig å merke seg at disse pilene har to ‘barbs’ på den spisse enden. Dette indikerer at et par elektroner har blitt donert. Hvis bare en elektron er donert, vil pilen bare ha ‘ en ‘ bard på den spisse enden.I Dette tilfellet Er Lewis-syren boran og Lewis-basen ER THF. Som du kan se, har basen donert et ensomt par elektroner til syren for å danne en oksygen-borbinding.Forbindelser som ikke er i stand til å danne addukter på grunn av molekylenes form kalles frustrerte Lewis-par.
Videre Lesing
http://www.chem.ucla.edu/~harding/IGOC/L/lewis_acid_base_adduct.html