Generic Name: epinastine hydrochloride
Dosage Form: ophthalmic solution
Medically reviewed by Drugs.com. Last updated on June 1, 2020.
- Overview
- Side Effects
- Dosage
- Professional
- Pregnancy
- More
Indications and Usage for Epinastine HCl Ophthalmic Solution
Epinastine HCl Ophthalmic Solution 0.05% er indikert for å forebygge kløe forbundet med allergisk konjunktivitt.
Epinastin HCl Oftalmisk Oppløsning Dosering og Administrasjon
den anbefalte dosen er en dråpe i hvert øye to ganger daglig.Behandling bør fortsette gjennom hele eksponeringsperioden (dvs. til pollensesongen er over eller til eksponering for det fornærmende allergenet er avsluttet), selv når symptomene er fraværende.
Doseringsformer og Styrker
Oppløsning inneholdende 0.5 mg/mL epinastin HCl
Kontraindikasjoner
Ingen
Advarsler og Forsiktighetsregler
Kontaminering av Spiss og Oppløsning
Pasienter bør instrueres om å unngå at tuppen av dispenseringsbeholderen kommer i kontakt med øyet, omkringliggende strukturer, fingre eller andre overflater for å unngå kontaminering av oppløsningen av vanlige bakterier som er kjent for å forårsake okulære infeksjoner. Alvorlig skade på øyet og påfølgende tap av syn kan skyldes bruk av forurensede løsninger.
Flasken skal holdes tett lukket når Den ikke er i bruk.
Bruk Med Kontaktlinser
Pasienter bør rådes til ikke å bruke kontaktlinser hvis øyet er rødt. Epinastin HCl Oftalmisk Oppløsning 0,05% bør ikke brukes til å behandle kontaktlinsrelatert irritasjon.konserveringsmiddelet I Epinastin HCl Oftalmisk Oppløsning 0,05%, benzalkoniumklorid, kan absorberes av myke kontaktlinser. Kontaktlinser bør fjernes før drypping Av Epinastin HCl Oftalmisk Oppløsning 0,05% og kan settes inn igjen etter 10 minutter etter administrering.
Bare Lokal Oftalmisk Bruk
Epinastin HCl Oftalmisk Oppløsning 0.05% er kun til lokal oftalmisk bruk og ikke til injeksjon eller oral bruk.
Bivirkninger
Kliniske Studier Opplever
fordi kliniske studier utføres under svært varierende forhold, kan bivirkningsrater observert i kliniske studier av et legemiddel ikke direkte sammenlignes med rater i kliniske studier av et annet legemiddel og kan ikke gjenspeile ratene observert i praksis.1-10% av pasientene var brennende følelse i øyet, follikulose, hyperemi og kløe.de hyppigst rapporterte ikke-okulære bivirkningene var infeksjon (forkjølelsessymptomer og øvre luftveisinfeksjoner), sett hos ca.10% av pasientene, og hodepine, rhinitt, sinusitt, økt hoste og faryngitt, sett hos ca. 1-3% av pasientene.
noen av disse reaksjonene var lik den underliggende sykdommen som ble studert.
Erfaring etter Markedsføring
følgende reaksjoner er identifisert ved bruk av Epinastin HCl Oftalmisk Oppløsning etter markedsføring 0,05% I klinisk praksis. Fordi de er rapportert frivillig fra en populasjon av ukjent størrelse, estimater av frekvens kan ikke gjøres. Reaksjonene, som er valgt for inklusjon på grunn av enten alvorlighetsgrad, rapporteringsfrekvens, mulig årsakssammenheng til Epinastin HCl Oftalmisk Oppløsning 0,05%, eller en kombinasjon av disse faktorene, inkluderer: økt tåreflod.
BRUK i SPESIFIKKE POPULASJONER
Graviditet
Teratogene Effekter
Graviditetskategori C
i en embryoføtal utviklingsstudie med drektige rotter ble det observert maternal toksisitet uten embryoføtale effekter ved en oral dose som var omtrent 150 000 ganger maksimal anbefalt okulær human dose (MROHD) på 0,0014 mg/kg/dag på mg/kg basis. Total resorpsjon og abort ble observert i en embryoføtal studie hos drektige kaniner ved en oral dose som var omtrent 55 000 ganger MROHD. I begge studiene ble det ikke observert medikamentinduserte teratogene effekter.
Epinastin reduserte pup-kroppsvekten etter en oral dose til drektige rotter som var omtrent 90 000 ganger MROHD.
det finnes imidlertid ingen adekvate og velkontrollerte studier hos gravide kvinner. Fordi reproduksjonsstudier på dyr ikke alltid er prediktive for human respons, Bør Epinastin HCl Oftalmisk Oppløsning 0,05% kun brukes under graviditet dersom den potensielle fordelen oppveier den potensielle risikoen for fosteret.
Ammende Mødre
en studie hos diegivende rotter viste utskillelse av epinastin i morsmelk. Det er ikke kjent om dette legemidlet utskilles i morsmelk hos mennesker. Fordi mange legemidler utskilles i morsmelk, bør forsiktighet utvises når Epinastin HCl Oftalmisk Oppløsning 0,05% administreres til en ammende kvinne.
Pediatrisk Bruk
Sikkerhet og effekt hos pediatriske pasienter under 2 år er ikke fastslått.
Geriatrisk Bruk
det er ikke observert noen generelle forskjeller i sikkerhet eller effekt mellom eldre og yngre pasienter.
Epinastin HCl Oftalmisk Oppløsning Beskrivelse
Epinastin HCl Oftalmisk Oppløsning 0.05% is a clear, colorless, sterile isotonic solution containing epinastine HCl, an antihistamine and an inhibitor of histamine release from the mast cell for topical administration to the eyes.
Epinastine HCl is represented by the following structural formula:
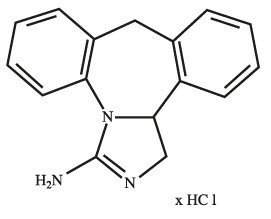
C16H15N3HCl Mol. Wt. 285.78
Chemical Name:
3-Amino-9,13b-dihydro-1H-dibenzimidazoazepine hydrochloride
Each mL contains: Active: Epinastine HCl 0.05% (0.5 mg/mL) equivalent to epinastine 0.044% (0.44 mg/mL); Preservative: Benzalkonium chloride 0.01%; Inactives: Edetat dinatrium, dihydrat; renset vann; natriumklorid; natriumfosfat, monobasisk, vannfritt; og natriumhydroksid og / eller saltsyre (for å justere pH).
Epinastin HCl Oftalmisk Oppløsning 0,05% har en pH på ca. 7 og et osmolalitetsområde på 250 til 310 mOsm / kg.
Epinastin HCl Oftalmisk Løsning-Klinisk Farmakologi
Virkningsmekanisme
Epinastin er en topisk aktiv, direkte h1-reseptorantagonist og en hemmer av frigjøring av histamin fra mastcellen. Epinastin er selektiv for histamin H1-reseptoren og har affinitet for histamin H2-reseptoren. Epinastin har også affinitet til α1-, α 2-og 5–HT2-reseptorene.
Farmakokinetikk
Fjorten personer med allergisk konjunktivitt fikk En dråpe Epinastin HCl Oftalmisk Oppløsning 0,05% i hvert øye to ganger daglig i 7 dager. På dag 7 ble gjennomsnittlig maksimal plasmakonsentrasjon av epinastin på 0,04±0,014 ng/ml nådd etter ca. to timer, noe som indikerer lav systemisk eksponering. Selv om disse konsentrasjonene representerte en økning i forhold til de som ble sett etter en enkeltdose, var dag 1 og dag 7-Området under Kurveverdiene uendret, noe som indikerer at det ikke er noen økning i systemisk absorpsjon ved gjentatt dosering. Epinastin er 64% bundet til plasmaproteiner. Total systemisk clearance er ca. 56 L / time og terminal eliminasjonshalveringstid i plasma er ca. 12 timer. Epinastin utskilles hovedsakelig uendret. Omtrent 55% av en intravenøs dose gjenfinnes uendret i urinen med omtrent 30% i avføring. Mindre enn 10% metaboliseres. Renal eliminasjon skjer hovedsakelig via aktiv tubulær sekresjon.
Preklinisk Toksikologi
Karsinogenese, Mutagenese, Nedsatt Fertilitet
i henholdsvis 18 måneder eller 2 år karsinogenitetsstudier i kosten hos mus eller rotter var epinastin ikke karsinogent ved doser opp til 40 mg / kg .
Epinastin i nylig syntetiserte grupper var negativ for mutagenisitet I ames / Salmonella-analysen og in vitro kromosomavviksanalyse ved bruk av humane lymfocytter. Positive resultater ble sett med tidlige grupper av epinastin i to in vitro kromosomavviksstudier utført på 1980-tallet med humane perifere lymfocytter og Med V79-celler. Epinastin var negativt i klastogenisitetsstudiene in vivo, inkludert mikronukleustesten for mus og kromosomavviktest hos Kinesiske Hamstere. Epinastin var også negativt i celletransformasjonsanalysen ved Bruk Av Syriske hamsterembryoceller, v79 / HGPRT mammalsk cellepunktmutasjonsanalyse og in vivo/in vitro uplanlagt DNA-synteseanalyse ved bruk av primære hepatocytter fra rotter.
Epinastin hadde ingen effekt på fertiliteten hos hannrotter. Redusert fertilitet hos hunnrotter ble observert ved en oral dose opp til ca. 90 000 GANGER MROHD.
Kliniske Studier
Epinastin HCl 0,05% har vist seg å være signifikant bedre enn kjøretøy for å forbedre okulær kløe hos pasienter med allergisk konjunktivitt i kliniske studier ved bruk av to forskjellige modeller: (1) conjunctival antigen challenge (CAC) hvor pasientene ble dosert og deretter fikk antigen innpodet i den dårligere conjunctival fornix; og (2) miljøfeltstudier hvor pasienter ble dosert og evaluert under allergisesongen i deres naturlige habitat. Resultatene viste rask innsettende effekt for epinastin HCl 0,05% innen 3 til 5 minutter etter konjunktival antigen-utfordring. Effektvarigheten ble vist å være 8 timer, noe som gjorde et to ganger daglig regime egnet. Dette doseringsregimet ble vist å være sikkert og effektivt i opptil 8 uker, uten tegn på takykylakse.
Hvordan Levert / Lagring og Håndtering
Epinastin HCl Oftalmisk Oppløsning 0.05% leveres sterile I ugjennomsiktige HVITE LDPE plastflasker med dråpespisser og hvite polypropylen (PP) caps som følger:
| 5 mL i 10 mL flaske | ndc 51991-836-75 |
lagring: lagre ved 20° – 25 hryvnias – 77°f) . Hold flasken tett lukket og utilgjengelig for barn.
Informasjon Om Pasientrådgivning
Sterilitet Av Dråpespiss
Pasienter bør rådes til ikke å berøre dråpespiss på noen overflate, da dette kan forurense innholdet (SE ADVARSLER og FORSIKTIGHETSREGLER, 5.1).
Samtidig Bruk av Kontaktlinser
Pasienter bør rådes til ikke å bruke kontaktlinser hvis øyet er rødt. Pasienter bør informeres om At Epinastin HCl Oftalmisk Oppløsning 0,05% ikke skal brukes til å behandle kontaktlinsrelatert irritasjon. Pasienter bør også rådes til å fjerne kontaktlinser før drypping Av Epinastin HCl Oftalmisk Oppløsning 0,05%.konserveringsmiddelet I Epinastin HCl Oftalmisk Oppløsning 0,05%, benzalkoniumklorid, kan absorberes av myke kontaktlinser. Brilleglass kan settes inn igjen etter 10 minutter etter Administrering av Epinastin HCl Oftalmisk Oppløsning 0,05%
Kun Lokal Oftalmisk Bruk
Kun for lokal oftalmisk administrasjon.
Bare Rx
Distribuert av:
Breckenridge Pharmaceutical, Inc.
Berlin, CT 06037
Produsert av:
PrimaPharma, Inc.
San Diego, CA 92121
Rev: 04/2020
2323 04/20
PRINCIPAL DISPLAY PANEL – 5 mL Bottle Carton
NDC 51991-836-75
Epinastine HCl
Ophthalmic
Solution,
0.05%
FOR USE IN THE
EYES ONLY
sterile
Rx Only
5 mL sterile
breckenridge
A Towa
Company

| EPINASTINE HYDROCHLORIDE epinastine hydrochloride solution/ drops |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Labeler – Breckenridge Pharmaceutical, Inc. (150554335)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| PrimaPharma, Inc. | 079699106 | MANUFACTURE(51991-836) | |
Mer om epinastin oftalmisk
- Bivirkninger
- Under Graviditet eller Amming
- Doseringsinformasjon
- Priser & Kuponger
- på engelsk
- 3 Anmeldelser
- Legemiddelklasse: oftalmiske antihistaminer og decongestants
Forbruker ressurser
- Pasientinformasjon
- Epinastin Oftalmisk (Avansert Lesing)
Faglige ressurser
Andre merker Elestat
Relaterte behandlingsveiledninger
- konjunktivitt, allergisk
medisinsk Ansvarsfraskrivelse