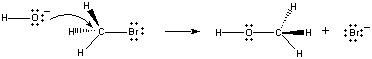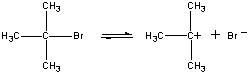Kjemisk Kinetikk
Kjemisk Kinetikk
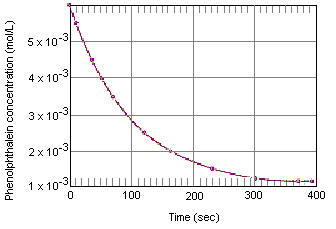
du kan være kjent med syrebasetitreringer som bruker fenolftalein som endepunktindikator. Du har kanskje ikke lagt merke til hva som skjer når en løsningsom inneholder fenolftalein i nærvær av overflødig base, får lov til å stå for noen fåminutter. Selv om løsningen i utgangspunktet har en rosa farge, blir den gradvis fargeløs somfenolftalein reagerer MED OH-ion i en sterkt grunnleggende løsning.tabellen nedenfor viser hva som skjer med konsentrasjonen av fenolftaleinin en løsning som i utgangspunktet var 0,005 M i fenolftalein og 0,61 M I OH-ion. Som du kan se når disse dataene er plottet i grafen nedenfor, reduseres fenolftalinkonsentrasjonen med en faktor på 10 over en periode på omtrent fire minutter.
Experimental Data for the Reaction Between Phenolphthalein and ExcessBase
| Concentration of Phenolphthalein (M) |
Time (s) | |
| 0.0050 | 0.0 | |
| 0.0045 | 10.5 | |
| 0.0040 | 22.3 | |
| 0.0035 | 35.7 | |
| 0.0030 | 51.1 | |
| 0.0025 | 69.3 | |
| 0.0020 | 91.6 | |
| 0.0015 | 120.4 | |
| 0.0010 | 160.9 | |
| 0.00050 | 230.3 | |
| 0.00025 | 299.6 | |
| 0.00015 | 350.7 | |
| 0.00010 | 391.2 |
Eksperimenter som den som ga oss dataene i tabellen ovenfor, er klassifisert som målinger av kjemisk kinetikk (fra en gresk stamme som betyr «tomove»). Et av målene med disse forsøkene er å beskrive reaksjonshastigheten som reaktantene forvandles til reaksjonsproduktene.
begrepet rate brukes ofte til å beskrive endringen i en mengdesom skjer per tidsenhet. Inflasjonsraten, for eksempel, er endringen igjennomsnittlig kostnad for en samling av standardelementer per år. Hastigheten som et objekt reiser gjennom rommet er avstanden som er reist per tidsenhet, for eksempel miles per time ellerkilometer per sekund. I kjemisk kinetikk er avstanden reist endringen ikonsentrasjon av en av komponentene i reaksjonen. Frekvensen av en reaksjon er derfor endringen i konsentrasjonen av en av reaktantene![]() (x)
(x)![]() som oppstår i løpet av en gitt tidsperiode
som oppstår i løpet av en gitt tidsperiode![]() t.
t.
![]()
praksis problem 1:
bruk dataene i tabellen ovenfor for å beregne hastigheten som fenolftalein reagerer med oh – ion under hver av følgende perioder:
(a) i løpet av første tidsintervall, når fenolftaleinkonsentrasjonen faller fra 0,0050 m til 0,0045 m.
(b) I løpet av det andre intervallet, når konsentrasjonen faller fra 0,0045 M til 0,0040 M.
(c) i løpet av det tredje intervallet, når konsentrasjonen faller fra 0,0040 m til 0,0035 M.
Klikk her for å sjekke svaret Ditt På Øvelsesproblem 1.
Klikk her for å se en løsning På Problem 1.
![]()
Øyeblikkelige Reaksjonshastigheter og Ratelagen for En Reaksjon
reaksjonshastigheten mellom fenolftalein og OH-ion er ikke konstant; den endres med tiden. Som de fleste reaksjoner, er frekvensen av denne reaksjonengradvis reduseres ettersom reaktantene forbrukes. Dette betyr at reaksjonshastigheten endres mens den måles.
for å minimere feilen dette introduserer i våre målinger, virker det tilrådelig å måle reaksjonshastigheten over tidsperioder som er korte sammenlignet med tiden det tar for reaksjonen å oppstå. Vi kan for eksempel prøve å måleden uendelig små endringen i konsentrasjon![]() d (X)
d (X) ![]() som oppstår over en uendelig kort periode av timedt. Forholdet mellom dissemengder er kjent som den øyeblikkelige reaksjonshastigheten.
som oppstår over en uendelig kort periode av timedt. Forholdet mellom dissemengder er kjent som den øyeblikkelige reaksjonshastigheten.
![]()
den øyeblikkelige reaksjonshastigheten til enhver tid kan beregnesfra en graf av konsentrasjonen av reaktanten (eller produktet) mot tiden. Grafen nedenfor viser hvordan reaksjonshastigheten for dekomponering av fenolftalein kan væreberegnes fra en graf av konsentrasjon mot tid. Reaksjonshastigheten når som helsti tid er lik hellingen til en tangent trukket til denne kurven i det øyeblikket.

den øyeblikkelige reaksjonshastigheten kan måles når som helst mellomøyeblikket der reaktantene blandes og reaksjonen når likevekt.Ekstrapolering av disse dataene tilbake til det øyeblikk reagensene blandes gir den initialinstantan reaksjonshastighet.
![]()
Rente Lover og Rate Konstanter
et interessant resultat oppnås når den øyeblikkelige reaksjonshastighetenberegnes på forskjellige punkter langs kurven i grafen iforrige seksjon. Reaksjonshastigheten på hvert punkt på denne kurven er direkteproporsjonal med konsentrasjonen av fenolftalein i det øyeblikket.
Rate = k(fenolftalein)
fordi denne ligningen er en eksperimentell lov som beskriver frekvensen avreaksjonen, kalles den hastighetsloven for reaksjonen. Proporsjonalitetskonstant, k, er kjent som hastighetskonstanten. Øvelse Problem 2: Beregn hastighetskonstanten for reaksjonen mellom fenolftalein og OH – ion hvis den øyeblikkelige reaksjonshastigheten er 2.5 x 10-5 mol per liter per sekund når konsentrasjonen av fenolftalein er 0,0025 M.
Klikk her for å sjekke svaret Ditt På Praksis Problem 2.
Klikk her for å se en løsning På Problem 2.Øvelsesproblem 3: Bruk hastighetskonstanten for reaksjonen mellom fenolftalein og OH-ion for å beregne den første øyeblikkelige reaksjonshastigheten for de eksperimentelle dataene som er oppført i forrige tabell.
Klikk her for å sjekke svaret Ditt På Øvelsesproblem 3.
Klikk her for å se en løsning På Problem 3.
![]()
Ulike Måter Å Uttrykke Reaksjonshastigheten på
det er vanligvis mer enn en måte å måle reaksjonshastigheten på. Wecan studere dekomponeringen av hydrogenjodid, for eksempel ved å måle hastigheten påsom Enten H2 eller I2 dannes i følgende reaksjon eller derat HVOR HI forbrukes.
2 HI(g) H2(g) + i2(g)
Eksperimentelt finner Vi at hastigheten Der I2 dannes erproporsjonal med kvadratet AV HI-konsentrasjonen når som helst.
![]()
Hva ville skje Hvis vi studerte hastigheten Der H2 dannes?Den balansert ligningen antyder At H2 og I2 må dannes påakkurat samme hastighet.
![]()
Hva ville skje, men hvis vi studerte hastigheten SOM HI forbrukesi denne reaksjonen? FORDI HI forbrukes, må endringen i konsentrasjonen være anegativt tall. Ved konvensjon rapporteres reaksjonshastigheten alltid som et positivtall. Vi må derfor endre tegn før vi rapporterer reaksjonshastigheten for areactant som forbrukes i reaksjonen.
![]()
det negative tegnet gjør to ting. Matematisk konverterer den en negativendring I konsentrasjonen AV HI til en positiv hastighet. Fysisk minner det oss om atkonsentrasjonen av reaktanten avtar med tiden.
Hva er forholdet mellom reaksjonshastigheten oppnådd vedovervåking av dannelsen Av H2 eller I2 og hastigheten oppnådd vedse HI forsvinne? Reaksjonens støkiometri sier at to HI-molekyler erkonsumeres for hvert molekyl Av H2 eller I2 produsert. Dette betyr atfrekvensen FOR dekomponering AV HI er dobbelt så rask som hastigheten Der H2 og I2 er dannet. Vi kan oversette dette forholdet til en matematisk ligning som følger.
![]()
som et resultat er hastighetskonstanten oppnådd ved å studere hastigheten Der H2og I2 dannes i denne reaksjonen (k) ikke den samme somhastighetskonstanten oppnådd ved å overvåke hastigheten DER HI forbrukes (k’)
Praksis Problem 4:
Beregn hastigheten SOM HI forsvinner i følgende reaksjon i øyeblikket Når I2 blir dannet med en hastighet på 1,8 x 10-6 mol per liter per sekund:
2 HI (g) ![]() H2(g) + I2 (g)
H2(g) + I2 (g)
Klikk her for å sjekke svaret Ditt På Øvelsesproblem 4.
Klikk her for å se en løsning På Problem 4.
![]()
Satsloven Versus Støkiometri av aReaction
På 1930-tallet studerte Sir Christopher Ingold Og kollegaer ved university ofLondon kinetikken til substitusjonsreaksjoner som følgende.
CH3Br(aq) + OH-(AQ)
ch3oh(aq) + br-(aq)
de fant at frekvensen av denne reaksjonen er proporsjonal.til konsentrasjonen av begge reaktantene.
Rate = k (CH3Br) (OH -)
Når de kjørte en lignende reaksjon på en litt annen startingmaterial, fikk de lignende produkter.
(CH3)3CBR (aq) + OH – (aq)
(CH3)3COH (aq) + Br – (aq)
men nå var reaksjonshastigheten proporsjonal med konsentrasjonen av bareen av reaktantene.
Rate = k ((CH3)3CBR)
disse resultatene illustrerer et viktig punkt: rate loven for areaction kan ikke forutsies fra støkiometri av reaksjonen; det må bestemmeseksperimentelt. Noen ganger er hastighetsloven i samsvar med det vi forventer fratokiometri av reaksjonen.
2 HI(g) H2(g) + I2(g)
Rate = k(HI)2 Often, however, it is not.
2 N2O5(g) 4 NO2(g) + O2(g)
Rate = k(n2o5)

rekkefølge av molekylaritet
noen reaksjoner oppstår i ett enkelt trinn. Reaksjonen der et kloratom overføres Fra ClNO2 TIL NO for å danne NO2 Og ClNO er en godeksempel på en en-trinns reaksjon.
ClNO2(g) + NO(g)
NO2(g) + ClNO(g)
Other reactions occur by a series of individual steps. N2O5,for example, decomposes to NO2 and O2 by a three-step mechanism.
Step 1: N2O5 NO2 + NO3
Trinn 2: NO2 + NO3 NO2 + no + o2
TRINN 3: 2 no2
trinnene i en reaksjon er klassifisert I FORM AV MOLEKYLARITET,som beskriver antall molekyler som forbrukes. Når en singlemolekyl forbrukes, kalles trinnet unimolekylært. Når to molekyler erkonsumert, det er bimolekylært.
Praksis Problem 5:
Bestem molekylariteten til hvert trinn i reaksjonen VED HVILKEN N2O5 dekomponerer TIL NO2 Og O2.
Klikk her for å sjekke svaret Ditt På Øvelsesproblem 5.
Klikk her for å se en Løsning På Problem 5.
Reaksjoner kan også klassifiseres i form av deres rekkefølge. Dekomponering AV N2O5 er en førsteordensreaksjon fordi reaksjonsraten avhenger av konsentrasjonen AV N2O5 hevet til den første kraften.
Rate = k(N2O5)
dekomponeringen AV HI er en andreordsreaksjon fordi rateof-reaksjonen avhenger av konsentrasjonen AV HI hevet til den andre effekten.
Rate = k (HI)2
når frekvensen av en reaksjon avhenger av mer enn enagent, klassifiserer vi reaksjonen i forhold til rekkefølgen av hvert reagens.
Praksis Problem 6:
Klassifiser rekkefølgen av reaksjonen MELLOM no og O2 for å danne NO2:
2 NO(g) + O2 (g)
2 NO2 (g)
Anta følgende sats lov for denne reaksjonen:
Rate = k (NO)2 (O2)
Klikk her for å sjekke svaret Ditt For Å Øve Problem 6.
forskjellen mellom molekylariteten og ordrenav en reaksjon er viktig. Molekylariteten til en reaksjon,eller et trinn i en reaksjon, beskriver hva som skjer på molekylært nivå. Ordren av en reaksjon beskriver hvaskjer på makroskopisk skala. Vi bestemmer rekkefølgen av en reaksjon ved å se påprodukter av en reaksjon vises eller reaktantene forsvinner. Reaksjonens molekylaritet er noe vi utleder for å forklare disse eksperimentelle resultatene.
Kollisjonsteori Modell Av Kjemiske Reaksjoner
kollisjonsteori modell av kjemiske reaksjoner kan brukes til åforklare de observerte rate lover for både ett-trinns og multi-trinns reaksjoner. Denne modellen antar at frekvensen av et hvilket som helst trinn i en reaksjon avhenger av frekvensen av kollisjoner mellom partiklene som er involvert i det trinnet.
figuren under gir grunnlag for å forstå implikasjonene av kollisjonsteorimodellen for enkle, ett-trinns reaksjoner, for eksempel følgende.
ClNO2 (g) + NO (g)
NO2(g) + ClNO(g)
den kinetiske molekylære teorien antar at antall kollisjoner forfølges i en gass avhenger av antall partikler per liter. Hastigheten Der No2 Og ClNO dannes i denne reaksjonen bør derfor være direkte proporsjonal med konsentrasjonen av Både ClNO2 og NO.
Rate = k(ClNO2)(NO)
kollisjonsteorimodellen antyder at frekvensen av et hvilket som helst trinn i areaksjon er proporsjonal med konsentrasjonene av reagensene som forbrukes i det trinnet. Dennes lov for en en-trinns reaksjon bør derfor være enig med støkiometri avvirkningen.
følgende reaksjon skjer for eksempel i et enkelt trinn.
CH3Br (aq) + OH – (aq)
CH3OH (aq) + Br – (aq)
når disse molekylene kolliderer i riktig retning, kan et parikke elektroner på OH – ion doneres til karbonatomet påsenteret Av ch3br-molekylet, som vist på figuren nedenfor.
når dette skjer, dannes en karbon-oksygenbinding samtidig som karbon-brom-bindingen brytes. Nettoresultatet av denne reaksjonen er substitusjonen av anOH-ion for En Br-ion. Fordi reaksjonen skjer i en enkelttrinn, som involverer kollisjoner mellom de to reaktantene, er frekvensen av denne reaksjonen proporsjonal med konsentrasjonen av begge reaktantene.
Rate = k(CH3Br)(OH -)
Ikke alle reaksjoner forekommer i ett enkelt trinn. Følgende reaksjon skjer itre trinn, som vist på figuren under.
(CH3)3CBR(aq) + OH-(AQ)
(CH3)3COH(aq) + Br-(aq)
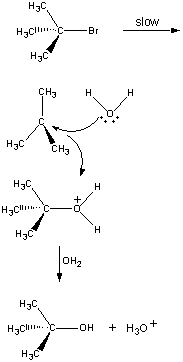
i det første trinnet er (CH3)3CBR molekyldissocieres til ET par ioner.
Første trinn den positivt ladede (ch3)3c+ ion reagerer Med vann I et andre trinn.
Andre trinn 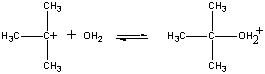
produktet av denne reaksjonen mister deretter et proton til enten oh-ion eller vann i det siste trinnet.
Tredje trinn 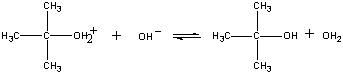
det andre og tredje trinnet i denne reaksjonen Er veldig Mye Raskere ennførst.
(CH3)3CBr (CH3)3C+ + Br-
Slow step (CH3)3C+ + H2O (CH3)3COH2+
Fast step (CH3)3COH2+ + OH- (CH3)3COH + H3O
Fast step The overall rate of reaction is therefore more or less equal to the rateof the first step. Det første trinnet kalles derfor hastighetsbegrensende trinn idenne reaksjonen fordi den bokstavelig talt begrenser hastigheten som reaksjonens produkter kan dannes. Fordi bare ett reagens er involvert i hastighetsbegrensende trinn, er overallraten av reaksjon proporsjonal med konsentrasjonen av bare dette reagenset.
Rate = k ((CH3)3CBR)
hastigheten loven for denne reaksjonen er derfor forskjellig fra hva vi wouldpredict fra støkiometri av reaksjonen. Selv om reaksjonen forbruker både (CH3)3CMERKE OH -, er reaksjonshastigheten bare proporsjonal med konsentrasjonen av (CH3)3CBR.
satsloven for kjemiske reaksjoner kan forklares med følgendegenerelle regler.
frekvensen av et hvilket som helst trinn i en reaksjon er direkte proporsjonal med konsentrasjonene av reagensene som forbrukes i det trinnet.den generelle rate loven for en reaksjon bestemmes av sekvensen av trinn, eller mekanismen, der reaktantene omdannes til produktene av reaksjonen.
den samlede rate loven for en reaksjon domineres av rate loven for det tregeste trinnet i reaksjonen.