Dipole
aby zrozumieć naturę niekowalentnych interakcji, najpierw musimy powrócić do wiązań kowalencyjnych i zagłębić się w temat dipoli. Wiele z wiązań kowalencyjnych, które widzieliśmy-na przykład między dwoma węglami lub między węglem a Wodorem –obejmuje w przybliżeniu równy podział elektronów między dwoma atomami w wiązaniu. W tych przykładach dwa atomy mają w przybliżeniu taką samą elektroujemność. Przypomnij sobie z kursu chemii ogólnej, że elektroujemność odnosi się do „mocy atomu w cząsteczce, aby przyciągnąć elektrony do siebie” (jest to definicja zaproponowana przez Linusa Paulinga, wybitnego amerykańskiego chemika XX wieku, który był przede wszystkim odpowiedzialny za opracowanie wielu koncepcji wiązania, których się uczyliśmy).
jednak dość często w chemii organicznej mamy do czynienia z wiązaniami kowalencyjnymi między dwoma atomami o różnej elektroujemności, a w tych przypadkach podział elektronów nie jest równy: im bardziej elektroujemne jądro przyciąga dwa elektrony bliżej. Na przykład w wiązaniu węgiel-tlen alkoholu, dwa elektrony w wiązaniu sigma są bliżej tlenu niż węgla, ponieważ tlen jest znacznie bardziej elektroujemny niż węgiel. To samo dotyczy wiązania tlen-wodór, ponieważ wodór jest nieco mniej elektroujemny niż węgiel, a znacznie mniej elektroujemny niż tlen.
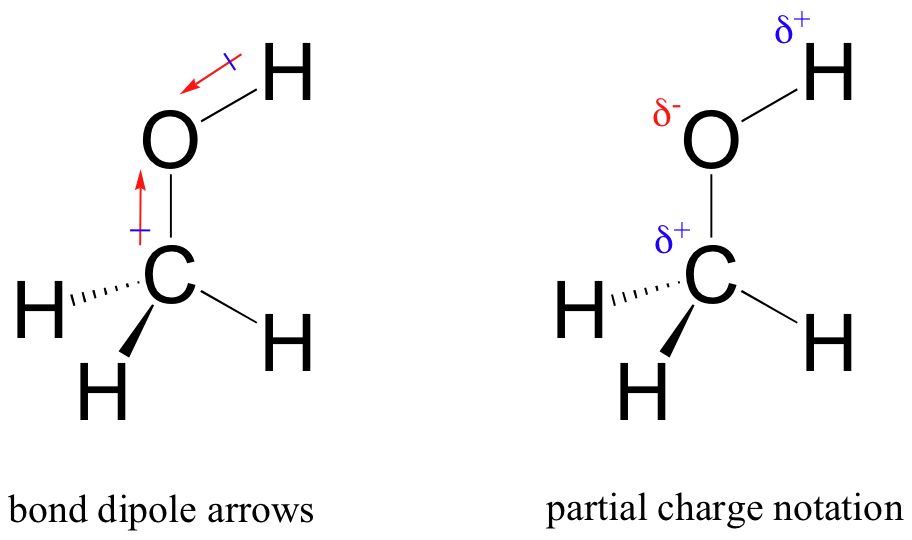
rezultatem tego nierównego podziału jest to, co nazywamy dipolem wiązania, który istnieje w polarnym wiązaniu kowalencyjnym. Dipol wiązania ma zarówno ujemne, jak i dodatnie końce, czyli bieguny, gdzie gęstość elektronów jest niższa (biegun dodatni) i wyższa (biegun ujemny). Różnica gęstości elektronów może być wyrażona za pomocą greckiej litery delta oznaczającej ładunek „częściowy dodatni” i „częściowy ujemny” na atomach. „Strzałki dipolowe”, ze znakiem dodatnim na ogonie, są również używane do wskazania ujemnego (większej gęstości elektronów) kierunku dipola.
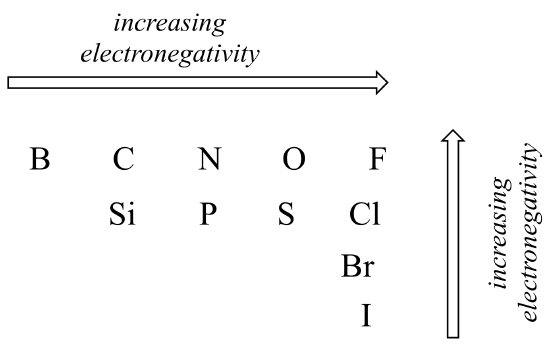
stopień polaryzacji wiązania kowalencyjnego zależy od różnicy elektroujemności między dwoma atomami. Elektroujemność jest tendencją okresową: zwiększa się od lewej do prawej w rzędzie układu okresowego pierwiastków, a także wzrasta, gdy poruszamy się w górę kolumny. Dlatego tlen jest bardziej elektroujemny niż azot, który z kolei jest bardziej elektroujemny niż węgiel. Tlen jest również bardziej elektroujemny niż Siarka. Fluor, w prawym górnym rogu układu okresowego, jest najbardziej elektroujemnym pierwiastkiem. Wodór jest nieco mniej elektroujemny niż węgiel.
okresowe trendy elektroujemności
ćwiczenie 2.26
korzystając z tego, co Ty o orbitalach atomowych, racjonalizuj okresowe trendy elektroujemności. Dlaczego zwiększa się od lewej do prawej, a zmniejsza się od góry do dołu? Jest to dobre pytanie, aby porozmawiać z kolegami z klasy i instruktorem lub korepetytorem.
rozwiązania do ćwiczeń
większość cząsteczek zawiera zarówno polarne, jak i niepolarne wiązania kowalencyjne. W zależności od położenia wiązań polarnych i geometrii wiązania, cząsteczki mogą posiadać polaryzację netto, zwaną molekularnym momentem dipolowym. Woda, jak zapewne pamiętacie, ma moment dipolowy, który wynika z połączonych dipoli jej dwóch wiązań tlen-wodór. Fluorometan ma również moment dipolowy.
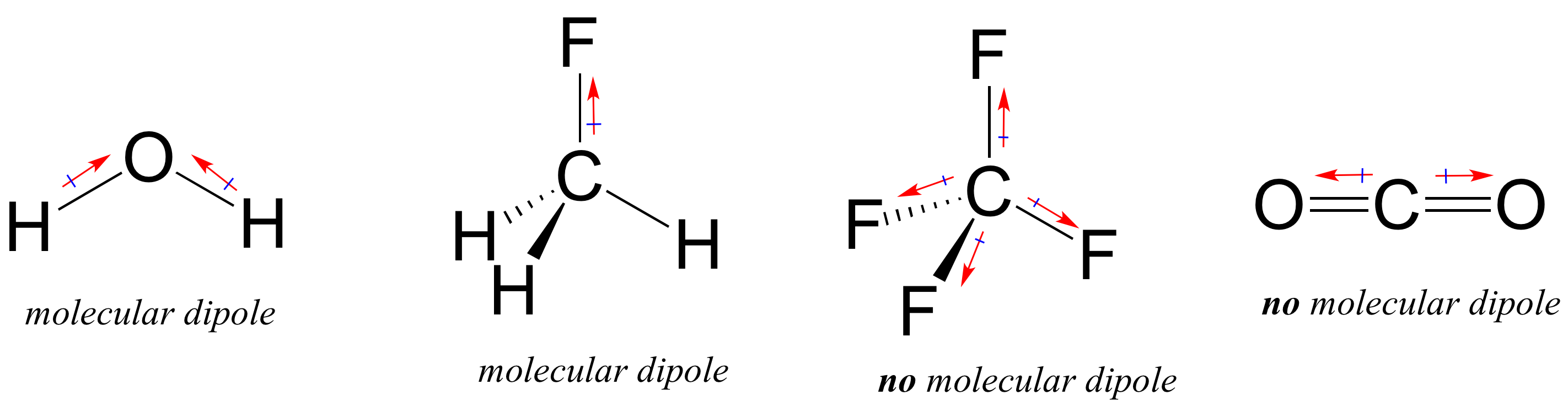
Tetrafluorometan ma jednak cztery wiązania biegunowe, które ciągną się równo do czterech narożników tetahedronu, co oznacza, że chociaż istnieją cztery dipole wiązania, nie ma ogólnego momentu dipolowego. Dwutlenku węgla brakuje również molekularnego momentu dipolowego.
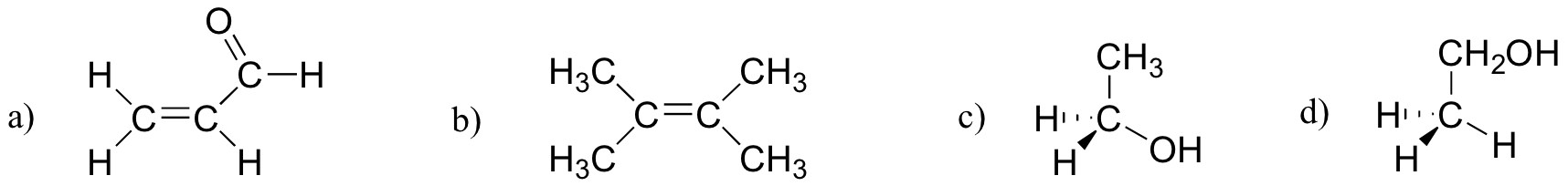
ćwiczenie 2.27
która z poniższych cząsteczek ma momenty dipolowe?
rozwiązania do ćwiczeń