Facts, Summary & Definition
- adducts jest produktem powstałym w wyniku reakcji adduktu
- Adducts może być utworzony tylko z reagentów, które mają wiele wiązań, takich jak alkenes i grupy karbonylowe
- Adducts może być utworzony przez dwa rodzaje Adducts. reakcja dodawania: Elektrofilowe i Nukleofilowe
- Addukty często tworzą się między kwasami Lewisa a zasadami Lewisa
Co to jest addukt?
addukt jest produktem powstającym pod koniec reakcji addycji. Jest to reakcja, w której dwie lub więcej cząsteczek reaguje i łączy się, tworząc jeden większy produkt. Ten rodzaj reakcji może zachodzić tylko pomiędzy związkami chemicznymi, które mają wiązania wielokrotne-związkami takimi jak Alken (wiązania podwójne) i alkiny (wiązania potrójne). Grupy karbonylowe (C = O) i iminowe (C=N) mogą również ulegać reakcjom addycyjnym, tworząc w ten sposób addukty.
jak powstają addukty?
jak wspomniano wcześniej, addukty powstają w wyniku reakcji dodawania. W tego typu reakcji wiązanie podwójne częściowo pęka, gdy reagująca cząsteczka atakuje i dodaje się. Poniższa reakcja przedstawia reakcję addycji pomiędzy etenem i bromem.

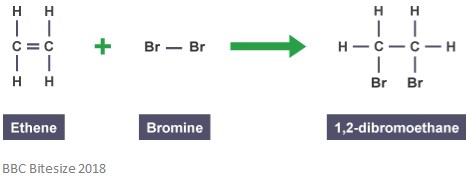
adduktem w tej reakcji jest 1,2-dibromoetan. To dlatego, że jest to odrębny gatunek, który zawiera wszystkie atomy wszystkich składników.
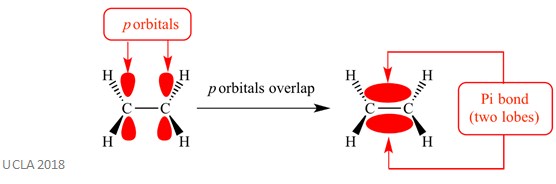
te reakcje dodawania zwykle obejmują wiązania pi (π). Jest to złożony rodzaj wiązania, w którym orbitale p na sąsiednich atomach nakładają się na siebie – To właśnie to nakładanie powoduje Wiązanie pi. Zachodzi to prostopadle do dowolnych wiązań sigma pomiędzy tymi dwoma tymi samymi atomami. To Wiązanie pi ma również dwa płaty orbitalne – jeden znajduje się powyżej płaszczyzny wiązania sigma, a drugi poniżej płaszczyzny wiązania sigma. Wiązanie pi pokazano na poniższym diagramie.

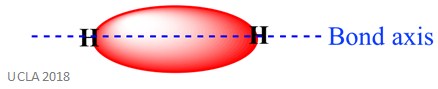
ta sama reakcja może również obejmować wiązania sigma (σ). Jest to rodzaj wiązania kowalencyjnego polegającego na nakładaniu się orbitali atomowych wzdłuż osi wiązania-innymi słowy, wzdłuż linii łączącej dwa połączone Atomy. Na przykład Wiązanie sigma w atomie wodoru powstaje przez nakładanie się dwóch orbitali 1s – po jednym z każdego atomu wodoru. Jest to lepiej pokazane na obrazku poniżej-czerwony obszar pokazuje Wiązanie sigma.

istnieją dwa główne typy reakcji addycji: addycja elektrofilowa i addycja nukleofilowa.
Addycja Elektrofilowa
reakcja addycji elektrofilowej jest rodzajem reakcji, w której Wiązanie zostaje zerwane i powstają dwa nowe wiązania. Jak wspomniano wcześniej, reagent musi mieć wiązanie podwójne lub potrójne-elektrofil dodaje do wiązania pi w tym przypadku. Jest to reakcja dodawania, a więc nic nie ginie w tym procesie-wszystkie atomy znajdujące się w reagujących cząsteczkach znajdują się również w addukcie.

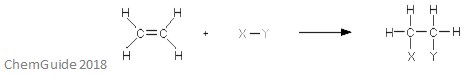
powyższy obraz przedstawia podstawową reakcję addycji elektrofilowej. Jak widać, wszystkie atomy reagentów znajdują się w addukcie.
Addycja Nukleofilowa
reakcja addycji nukleofilowej jest rodzajem reakcji, w której wiązanie podwójne zostaje zerwane i powstają dwa wiązania pojedyncze. Niedobór elektronów (elektrofilowe) wiązanie podwójne lub potrójne reaguje z czymś, co jest bogate w elektrony (nukleofilowe). Nukleofil dodaje do wiązania pi w tym przypadku. Przykład reakcji addycji nukleofilowej przedstawiono poniżej.

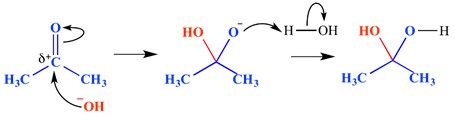
w tym przykładzie jon wodorotlenkowy został dodany do delta dodatniego końca grupy karbonylowej – to utworzyło oksyanionową czworościanową cząsteczkę pośrednią. Efektem końcowym jest zatem dodanie wody przez wiązanie grupy karbonylowej pi.
kwasy Lewisa i zasady Lewisa
Addukty często tworzą się między kwasami Lewisa a Zasadami Lewisa. Utworzona cząsteczka nazywana jest adduktem kwasowo-zasadowym Lewisa (lub kompleksem kwasowo-zasadowym Lewisa). Ponieważ addukty powstają tylko poprzez reakcje addycyjne (to znaczy bez jednoczesnej utraty grupy), reakcje Lewis-acid i Lewis-base nie mogą być reakcjami typu substytucyjnego.
dobrym przykładem jest reakcja między THF i BH3, która jest pokazana na poniższym obrazku. Jak widać, te addukty kwasu Lewisa-Zasady Lewisa są pokazane z kropkami-te reprezentują elektrony.

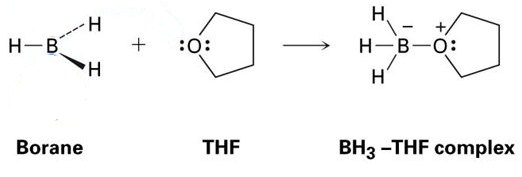
jak widać, jedynym wytworzonym produktem jest kompleks BH3-THF, co oznacza, że jest to addukt.
tego typu reakcje można również przedstawić za pomocą strzałek – strzałki te przedstawiają oddawanie elektronów z zasady do kwasu. Ta sama reakcja jest pokazana poniżej, ale ze strzałkami wskazującymi oddawanie elektronów.

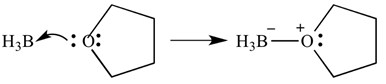
ważne jest, aby pamiętać, że te strzałki mają dwa 'kolce’ na spiczastym końcu. Oznacza to, że para elektronów została oddana. Jeśli tylko jeden elektron zostanie przekazany, strzałka będzie miała tylko „jeden” bard na spiczastym końcu.
w tym przypadku kwas Lewisa to boran, a zasada Lewisa to THF. Jak widać, baza oddała do kwasu samotną parę elektronów, tworząc wiązanie tlen-Bor.
związki, które ze względu na kształt cząsteczek nie są w stanie tworzyć adduktów nazywane są parami Lewisa.
Czytaj dalej
http://www.chem.ucla.edu/~harding/IGOC/L/lewis_acid_base_adduct.html