Patofizjologia VIVO
inne tematy
akwaporyny: kanały wodne
woda przenika przez błony komórkowe dwoma drogami: przez dyfuzję przez dwuwarstwę lipidową i przez kanały wodne zwane akwaporynami. Funkcjonalna charakterystyka pierwszej akwaporyny została zgłoszona w 1992 roku, ale podejrzewano, że kanały wodne istniały znacznie wcześniej, ponieważ przepuszczalność osmotyczna niektórych typów komórek nabłonkowych była zbyt duża, aby można było ją wytłumaczyć prostą dyfuzją przez błonę plazmatyczną.
pojedynczy ludzki kanał aquaporin-1 ułatwia transport wody z prędkością około 3 miliardów cząsteczek wody na sekundę. Taki transport wydaje się być dwukierunkowy, zgodnie z dominującym gradientem osmotycznym.
Klasyczne akwaporyny transportują rozpuszczoną wodę przez błony komórkowe; wydają się być wyłącznymi kanałami wodnymi i nie przenikają błon do jonów lub innych małych cząsteczek. Niektóre akwaporyny-znane jako aquagliceroporiny-transportują wodę plus glicerol i kilka innych małych cząsteczek.
Rodzina akwaporyn
do tej pory zidentyfikowano ponad 10 różnych akwaporyn ssaków i podejrzewa się istnienie dodatkowych członków. Blisko spokrewnione białka kanału wodnego zostały wyizolowane z roślin, owadów i bakterii. Aquaporin-1 z ludzkich czerwonych krwinek został pierwszy odkryty i jest prawdopodobnie najlepiej zbadany.
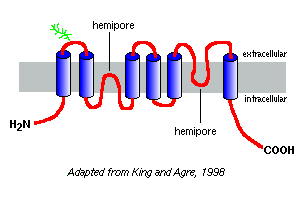
wykresy hydrofobowości ich sekwencji aminokwasowych przewidują, że akwaporyny mają sześć segmentów obejmujących błonę, jak pokazano w modelu akwaporyny-1 po prawej stronie.
na podstawie badań z akwaporyną-1 wynika, że akwaporyny występują w błonie osocza jako homotetramery. Każdy monomer aquaporin zawiera dwie pory połowiczne, które składają się razem, tworząc kanał wodny.
różne akwaporyny mają różne wzorce glikozylacji. W przypadku akwaporyny-1 szkielet peptydowy wynosi około 28 kDa, a formy glikozylowane wahają się od 40 do 60 kDa w masie. Większość akwaporyn ma kinazę białkową a motyw fosforylacji w jednej z pętli cytoplazmatycznych, a fosforylacja różnicowa jest podejrzewana o nadanie cząsteczce funkcji regulacyjnej.
wzorce ekspresji akwaporyny
każda z akwaporyn ma zasadniczo unikalny wzór ekspresji wśród tkanek i podczas rozwoju. Podsumowanie tych atrybutów i niektórych ważnych potencjalnych lub znanych funkcji przedstawiono w poniższej tabeli:
| główne miejsca ekspresji | ||
|---|---|---|
| Aquaporin-0 | oko: komórki włókien soczewkowych | równowaga płynów w soczewce |
| krwinki czerwone | Ochrona osmotyczna | |
| nerki: proximal tubule | Concentration of urine | Eye: ciliary epithelium | Production of aqueous humor | Brain: choriod plexus | Production of cerebrospinal fluid | Lung: alveolar epithelial cells | Alveolar hydration state |
| Aquaporin-2 | Kidney: collecting ducts | Mediates antidiuretic hormone activity |
| Aquaporin-3 * | Kidney: collecting ducts | Reabsorbtion of water into blood |
| Trachea: komórki nabłonkowe | wydzielanie wody do tchawicy | |
| Aquaporin-4 | nerki: kanały zbierające | Reabsorbcja wody |
| mózg: komórki wyściółkowe | równowaga płynu mózgowo-rdzeniowego | |
| mózg: podwzgórze | funkcja osmozy? | |
| : nabłonek oskrzeli | wydzielanie płynu oskrzelowego | |
| Aquaporin-5 | gruczoły ślinowe | produkcja śliny |
| gruczoły łzowe | ||
| Aquaporin-6 | nerki | bardzo niska przepuszczalność wody; funkcja? |
| komórki tłuszczowe | transportuje glicerol z adipocytów | |
| jądra i plemniki | ||
| Aquaporin-8 | Jądra, trzustka, wątroba, inne | |
| aquaporin-9 * | leukocyty | |
| * aquaglyceroporin | ||
akwaporyny są bardzo szeroko rozpowszechnione, a także to, że różne akwaporyny mają różne funkcjonalnie ważne specjalności.
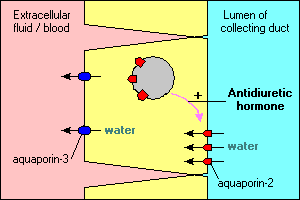
kilka ciekawych i ważnych cech transportu wodnego za pośrednictwem akwaporyny zilustrowano w głównych komórkach, które tworzą kanały zbiorcze w nerkach. Woda przepływająca przez te kanały może kontynuować i zostać wydalona z moczem lub zostać ponownie wchłonięta przez nabłonek i z powrotem do krwi. Reabsorpcja jest zasadniczo zerowa, chyba że komórki nabłonkowe widzą hormon antydiuretyczny, który silnie stymuluje reabsorpcję wody. Komórki kanałowe zbierające wykazują ekspresję co najmniej dwóch akwaporyn:
- Aquaporin-2 jest syntetyzowany, ale w nieobecności hormonu antydiuretycznego znajduje się w Puli pęcherzyków błonowych w cytoplazmie. Wiązanie hormonu antydiuretycznego z jego receptorem w komórce nie tylko stymuluje transkrypcję genu akwaporyny – 2, ale powoduje wprowadzenie wewnątrzkomórkowej puli akwaporyny-2 do błony wierzchołkowej. Komórka jest teraz w stanie skutecznie pobierać wodę z światła kanału.
- Akwaporyna-3 ulega konstytutywnej ekspresji w błonie podstawno-bocznej komórki. Kiedy woda zalewa komórkę przez kanały akwaporyny-2, może szybko opuścić komórkę przez kanały akwaporyny-3 i przedostać się do krwi.
akwaporyny i choroby
biorąc pod uwagę znaczenie transportu wody w niezliczonych procesach fizjologicznych, należy się spodziewać, że zmiany w genach akwaporyny lub nabyte zaburzenia w akwaporynach mogą powodować lub przyczyniać się do kilku stanów chorobowych. Poszukiwanie takich połączeń jest jeszcze wczesne, ale zidentyfikowano dwa wyraźne przykłady chorób jako wynikające z niedoboru akwaporyn:
- mutacje w genie aquaporin-2 powodują dziedziczną nefrogeniczną cukrzycę moczówki prostej u ludzi.
- myszy homozygotyczne do inaktywacji mutacji w genie aquaporin-0 rozwijają wrodzoną zaćmę.
- otyłość dorosłych rozwija się u myszy homozygotycznych do inaktywacji mutacji w genie he aquaporin-7, prawdopodobnie z powodu nieefektywności w transporcie glicerolu z hydrolizowanych magazynów trójglicerydów.
niewielka liczba osób została zidentyfikowana z ciężkim lub całkowitym niedoborem akwaporyny-1. Co ciekawe, wydają się klinicznie nienaruszone, ale nie zostały zbadane w warunkach braku wody. Myszy z ukierunkowanymi delecjami w akwaporynie-1 również wydają się normalne i zdrowe, chyba że są ograniczone płynem, w którym to przypadku stają się poważnie hiperosmolarne.
Referencje i recenzje
- Borgnia m, Nielsen s, Engel a, Agre P: Cellular and molecular biology of aquaporin water channels. Annu Rev Biochem 68: 425, 1999.
- deGroot BL, Grubmuller H: przenikanie wody przez błony biologiczne: mechanizm i dynamika akwaporyny-1 i GlpF. Nauka 294:2353, 2001.
- Hibuse T, Proc Nat Acad Sci (USA) 102:10993, 2005.
- King LS, Agre P: Pathophysiology of the aquaporin water channels. Annu Rev Physiol 58: 619, 1998.
- Knepper MA, Inoue T: Regulacja kanału wodnego aquaporin-2 przez wazopresynę. Curr Opinion Cell Biol 9: 560, 1997.
- Lee MD, King LS, Agre P: rodzina białek kanału wodnego aquaporin w medycynie klinicznej. Medicine 76:141, 1997.
- Preston GM, Carroll TP, GUGGINO WP Agre P: Appearance of water channels in Xenopus oocytes expressing red cell CHIP28 protein. Nauka 256:385, 1992.
- Sasaki S, Ishibashi K, Marumo F: Aquaporin-2 i -3: przedstawiciele dwóch podgrup rodziny aquaporin colocalized w kanale zbierającym nerki. Annu Rev Physiol 60: 199, 1998.