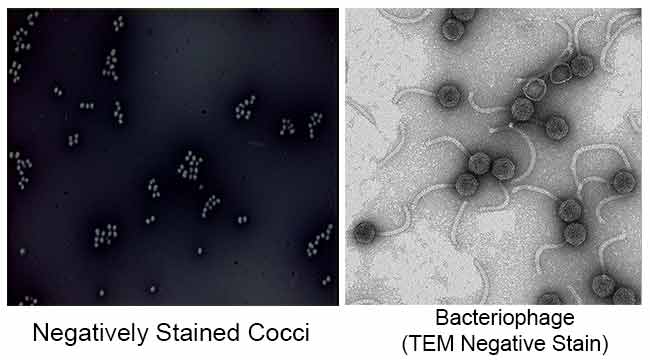
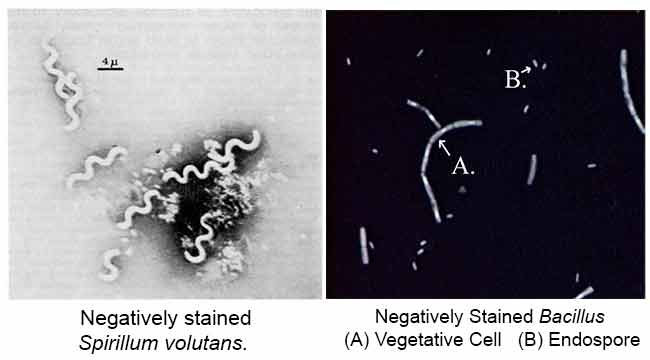
głównym celem barwienia ujemnego jest badanie morfologicznego kształtu, wielkości i ułożenia komórek bakterii, które są trudne do barwienia. np: Spirilla. Może być również stosowany do barwienia komórek, które są zbyt delikatne, aby można je było utrwalić na gorąco.
jest również używany do przygotowania próbek biologicznych do mikroskopii elektronowej. Służy do oglądania wirusów, bakterii, wici bakteryjnej, biologicznych struktur błonowych i białek lub agregatów białkowych, które mają niską moc rozpraszania elektronów. Jest również stosowany do badania i identyfikacji wodnych agregatów lipidowych, takich jak liposomy płytkowe (le), odwrócone sferyczne micele (M) i odwrócone sześciokątne cylindryczne hii (H) fazy przez ujemne barwienie transmisyjnej mikroskopii elektronowej.
zasada barwienia ujemnego
barwienie ujemne wymaga kwaśnego barwnika, takiego jak atrament Indyjski lub Nigrosin.
India Ink lub Nigrosin to kwaśna plama. Oznacza to, że plama łatwo rezygnuje z jonu wodorowego (protonu), a chromofor barwnika staje się ujemnie naładowany. Ponieważ powierzchnia większości komórek bakteryjnych jest naładowana ujemnie, powierzchnia komórki odpycha plamę. Szkło szkiełka będzie plamić, ale komórki bakteryjne nie. Bakterie pojawią się jako wyraźne plamy na ciemnym tle.
odczynniki barwienia ujemnego
India ink
Nigrosin
Nigrosin 100 gm/L, Formalina 5 ml/l w wodzie
procedura barwienia ujemnego
1. Umieścić bardzo małą kroplę (więcej niż pętla pełna, mniej niż swobodna spadająca kropla z zakraplacza) nigrosin w pobliżu jednego końca dobrze oczyszczonego i podpalonego szkiełka.
2. Usunąć niewielką ilość kultury ze skosu za pomocą pętli szczepiącej i rozproszyć ją w kropli plamy bez rozprzestrzeniania się kropli.

3. Użyj innego czystego szkiełka, aby rozprowadzić kroplę plamy zawierającej organizm, stosując następującą technikę.

Pozostaw jeden koniec czystego prowadnicy na środku prowadnicy z plamą. Przechyl czystą prowadnicę w kierunku kropli, tworząc ostry kąt i przeciągnij ją w kierunku kropli, aż dotknie kropli i spowoduje jej rozłożenie wzdłuż krawędzi prowadnicy. Zachowując mały kąt ostry między prowadnicami, popchnij prowadnicę do czystego końca prowadnicy, który jest zabrudzony, przeciągając kroplę za prowadnicą i wytwarzając szeroki, równomierny, cienki rozmaz.
 |
 |
5. Pozostawić rozmaz do wyschnięcia bez ogrzewania.

6. Skoncentruj cienki obszar pod zanurzeniem w oleju i obserwuj nieutwardzone komórki otoczone szarą plamą.
procedura przeglądania w transmisyjnym mikroskopie elektronowym (tem)
- przytrzymaj powleczoną siatkę flim side up w parze samoprzylepnych kleszczy.
- wykonaj 1: 1 mieszaninę próbki i negatywowej plamy (np. 2% octanu uranylu lub 2% fosfotungstatu sodu lub potasu, pH 7,4). Dodaj 5µl do siatki. Mniejsze cząstki adsorbują się na powierzchni siatki szybciej niż większe cząstki.
alternatywnie próbkę zmieszaną z utrwalaczem można dodać do siatki przed kolejnym negatywnym zabarwieniem. - inkubować przez 30-90 sekund, a następnie usunąć nadmiar płynu rozdartą krawędzią
kawałka papieru filtracyjnego. - wysusz na powietrzu i zbadaj w TEM.
wyniki przebarwień ujemnych