Generic Name: epinastine hydrochloride
Dosage Form: ophthalmic solution
Medically reviewed by Drugs.com. Last updated on June 1, 2020.
- Overview
- Side Effects
- Dosage
- Professional
- Pregnancy
- More
Indications and Usage for Epinastine HCl Ophthalmic Solution
Epinastine HCl Ophthalmic Solution 0.05% jest wskazany w zapobieganiu swędzeniu związanym z alergicznym zapaleniem spojówek.
Epinastyna HCl roztwór oftalmiczny Dawkowanie i sposób podawania
zalecana dawka to jedna kropla do każdego oka dwa razy na dobę.
leczenie należy kontynuować przez cały okres ekspozycji (tj. do zakończenia sezonu pyłkowego lub do momentu zakończenia ekspozycji na szkodliwy alergen), nawet gdy objawy nie występują.
postacie dawkowania i moce
roztwór zawierający 0.5 mg / mL Epinastyny HCl
przeciwwskazania
brak
ostrzeżenia i środki ostrożności
zanieczyszczenie końcówki i roztworu
pacjenci powinni być poinstruowani, aby nie dopuścić do kontaktu końcówki pojemnika dozującego z okiem, otaczającymi strukturami, palcami lub jakąkolwiek inną powierzchnią w celu uniknięcia zanieczyszczenia roztworu przez powszechnie znane bakterie powodujące zakażenia oczu. W wyniku stosowania zanieczyszczonych roztworów może dojść do poważnego uszkodzenia oka, a następnie utraty wzroku.
butelka powinna być szczelnie zamknięta, gdy nie jest używana.
stosowanie z soczewkami kontaktowymi
pacjentom należy zalecić, aby nie zakładali soczewek kontaktowych, jeśli ich oko jest czerwone. Epinastyna HCl roztwór oftalmiczny 0,05% nie powinna być stosowana w leczeniu podrażnień związanych z soczewkami kontaktowymi.
środek konserwujący w 0,05% roztworze okulistycznym Epinastyny HCl, chlorek benzalkoniowy, może być wchłaniany przez miękkie soczewki kontaktowe. Soczewki kontaktowe należy usunąć przed zakropleniem 0,05% roztworu oftalmicznego Epinastyny HCl i można je ponownie założyć po 10 minutach od podania.
tylko do stosowania miejscowego do okulistyki
Epinastyna HCl roztwór do okulistyki 0.05% przeznaczone jest wyłącznie do miejscowego stosowania okulistycznego, a nie do iniekcji lub podawania doustnego.
działania niepożądane
doświadczenia w badaniach klinicznych
ponieważ badania kliniczne prowadzone są w bardzo różnych warunkach, częstość występowania działań niepożądanych obserwowanych w badaniach klinicznych leku nie może być bezpośrednio porównywana z częstością obserwowaną w badaniach klinicznych innego leku i może nie odzwierciedlać częstości obserwowanej w praktyce.
najczęściej zgłaszanymi działaniami niepożądanymi narządu wzroku, występującymi u około 1-10% pacjentów, były uczucie pieczenia w oku, czyraka, przekrwienie i świąd.
najczęściej zgłaszanymi działaniami niepożądanymi niezwiązanymi z okiem były zakażenia (objawy przeziębienia i zakażenia górnych dróg oddechowych), obserwowane u około 10% pacjentów, oraz bóle głowy, nieżyt nosa, zapalenie zatok, nasilony kaszel i zapalenie gardła, obserwowane u około 1-3% pacjentów.
niektóre z tych reakcji były podobne do choroby podstawowej, w której występowała.
doświadczenie po wprowadzeniu produktu do obrotu
w praktyce klinicznej podczas stosowania 0, 05% roztworu oftalmicznego Epinastyny HCl po wprowadzeniu do obrotu stwierdzono następujące reakcje. Ponieważ są one zgłaszane dobrowolnie z populacji o nieznanej wielkości, nie można oszacować częstości występowania. Reakcje, które zostały wybrane do włączenia ze względu na ich stopień nasilenia, częstotliwość zgłaszania, możliwy związek przyczynowy z 0,05% roztworem okulistycznym HCl Epinastyny lub połączenie tych czynników, obejmują: zwiększone łzawienie.
stosowanie w określonych populacjach
ciąża
działanie teratogenne
ciąża Kategoria C
w badaniu rozwoju zarodka i płodu u ciężarnych szczurów, po doustnej dawce wynoszącej około 150 000 razy więcej niż maksymalna zalecana dawka do oczu u ludzi (MROHD) wynosząca 0, 0014 mg/kg mc./dobę w przeliczeniu na mg / kg mc. Całkowita resorpcja i aborcja były obserwowane w badaniu embrionalno-płodowym u ciężarnych królików w dawce doustnej, która była około 55 000 razy większa od MROHD. W obu badaniach nie stwierdzono działania teratogennego wywołanego lekiem.
Epinastyna zmniejszała przyrost masy ciała szczeniąt po podaniu doustnym ciężarnym samicom szczurów, który był około 90 000 razy większy od MROHD.
nie przeprowadzono jednak odpowiednich i dobrze kontrolowanych badań u kobiet w ciąży. Ze względu na to, że badania na zwierzętach dotyczące wpływu na reprodukcję nie zawsze przewidują odpowiedź człowieka, roztwór Okulistyczny HCl Epinastyny 0,05% należy stosować w okresie ciąży tylko wtedy, gdy potencjalne korzyści przewyższają potencjalne ryzyko dla płodu.
matki karmiące
badanie na karmiących szczurach wykazało wydzielanie epinastyny do mleka matki. Nie wiadomo, czy lek ten przenika do mleka kobiecego. Ponieważ wiele leków jest wydzielanych z mlekiem kobiecym, należy zachować ostrożność podczas podawania 0,05% roztworu oftalmicznego Epinastyny HCl kobietom karmiącym piersią.
stosowanie u dzieci
nie określono bezpieczeństwa stosowania i skuteczności u dzieci w wieku poniżej 2 lat.
stosowanie w podeszłym wieku
nie obserwowano ogólnych różnic w bezpieczeństwie lub skuteczności pomiędzy pacjentami w podeszłym wieku i młodszymi.
Epinastyna HCl roztwór oftalmiczny opis
Epinastyna HCl roztwór oftalmiczny 0.05% is a clear, colorless, sterile isotonic solution containing epinastine HCl, an antihistamine and an inhibitor of histamine release from the mast cell for topical administration to the eyes.
Epinastine HCl is represented by the following structural formula:
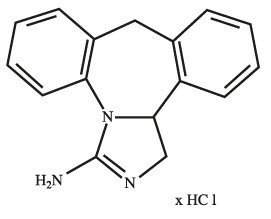
C16H15N3HCl Mol. Wt. 285.78
Chemical Name:
3-Amino-9,13b-dihydro-1H-dibenzimidazoazepine hydrochloride
Each mL contains: Active: Epinastine HCl 0.05% (0.5 mg/mL) equivalent to epinastine 0.044% (0.44 mg/mL); Preservative: Benzalkonium chloride 0.01%; Inactives: Sodu edetynian dwuwodny; woda oczyszczona; sodu chlorek; sodu fosforan jednozasadowy bezwodny; sodu wodorotlenek i (lub) kwas solny (do ustalenia pH).
roztwór Okulistyczny HCl Epinastyny 0,05% ma pH około 7 i zakres osmolalności od 250 do 310 mOsm/kg.
Epinastyna HCl roztwór oftalmiczny – Farmakologia kliniczna
mechanizm działania
Epinastyna jest miejscowo aktywnym, bezpośrednim antagonistą receptora H1 i inhibitorem uwalniania histaminy z komórek tucznych. Epinastyna jest selektywna wobec receptora histaminowego H1 i wykazuje powinowactwo do receptora histaminowego H2. Epinastyna wykazuje również powinowactwo do receptorów α1, α2-i 5-HT2.
farmakokinetyka
czternastu pacjentów z alergicznym zapaleniem spojówek otrzymywało jedną kroplę 0,05% roztworu Epinastyny HCl do każdego oka dwa razy na dobę przez 7 dni. W 7. dniu średnie maksymalne stężenie epinastyny w osoczu wynoszące 0,04±0,014 ng / ml osiągane było po około dwóch godzinach, co wskazuje na małą ekspozycję ogólnoustrojową. Chociaż stężenia te zwiększały się w stosunku do stężeń obserwowanych po podaniu pojedynczej dawki, wartości pola Pod Krzywą (AUC) w 1.i 7. dniu nie uległy zmianie, co wskazuje na brak zwiększenia wchłaniania ogólnoustrojowego po podaniu wielokrotnym. Epinastyna wiąże się z białkami osocza w 64%. Całkowity klirens układowy wynosi około 56 L/H, a końcowy okres półtrwania w osoczu wynosi około 12 godzin. Epinastyna jest wydalana głównie w postaci niezmienionej. Około 55% dawki dożylnej jest odzyskiwane w postaci niezmienionej w moczu, a około 30% w kale. Mniej niż 10% jest metabolizowane. Wydalanie nerkowe odbywa się głównie poprzez aktywne wydzielanie kanalikowe.
Toksykologia Niekliniczna
Rakotwórczość, mutageneza, upośledzenie płodności
w 18-miesięcznych lub 2-letnich badaniach rakotwórczości z żywnością u myszy lub szczurów, odpowiednio, epinastyna nie wykazywała działania rakotwórczego w dawkach do 40 mg/kg mc .
Epinastyna w nowo zsyntetyzowanych partiach wykazywała ujemny wynik mutagenności w teście Amesa/Salmonella oraz w teście aberracji chromosomowej in vitro z wykorzystaniem ludzkich limfocytów. Pozytywne wyniki zaobserwowano we wczesnych partiach epinastyny w dwóch badaniach aberracji chromosomalnej in vitro przeprowadzonych w latach 80., odpowiednio z ludzkimi limfocytami obwodowymi i komórkami V79. Epinastyna była ujemna w badaniach klastogenności in vivo, w tym w teście mikrojąderkowym u myszy i teście aberracji chromosomowej u chomików Chińskich. Epinastyna była również ujemna w teście transformacji komórek z użyciem komórek zarodka chomika syryjskiego, w teście mutacji punktowej komórek ssaczych V79/HGPRT oraz w teście nieplanowanej syntezy DNA in vivo/in vitro z użyciem pierwotnych hepatocytów szczura.
Epinastyna nie miała wpływu na płodność samców szczurów. Zmniejszenie płodności samic szczurów obserwowano po podaniu doustnym dawki do około 90 000 razy większej od MROŻD.
badania kliniczne
wykazano, że Epinastyna HCl 0,05% jest znacząco lepsza od nośnika w celu poprawy świądu oka u pacjentów z alergicznym zapaleniem spojówek w badaniach klinicznych z wykorzystaniem dwóch różnych modeli: (1) prowokacji antygenu spojówkowego (CAC), w której pacjentom podawano, a następnie otrzymywano antygen zaszczepiony do dolnego odcinka spojówki; oraz (2) środowiskowe badania terenowe, w których pacjenci byli dawkowani i oceniani w okresie alergii w ich naturalnym środowisku. Wyniki wykazały szybki początek działania HCl epinastyny 0,05% w ciągu 3 do 5 minut po prowokacji antygenem spojówkowym. Wykazano, że czas działania wynosi 8 godzin, co sprawia, że odpowiednie jest podawanie dwa razy na dobę. Wykazano, że ten schemat dawkowania jest bezpieczny i skuteczny przez okres do 8 tygodni, bez objawów tachyfilaksji.
sposób dostawy/Przechowywanie i obsługa
Epinastyna HCl roztwór oftalmiczny 0.05% jest dostarczany sterylnie w nieprzezroczystych białych plastikowych butelkach LDPE z końcówkami kroplomierza i białymi nasadkami polipropylenowymi (PP) w następujący sposób:
| 5 mL w butelce 10 mL | NDC 51991-836-75 |
Przechowywanie: Przechowywać w temperaturze 20° – 25°c (68° – 77°F) . Przechowywać butelkę szczelnie zamkniętą i niedostępną dla dzieci.
informacje dotyczące porad dla pacjentów
sterylność końcówki kroplomierza
pacjentom należy zalecić, aby nie dotykali końcówki kroplomierza do żadnej powierzchni, ponieważ może to spowodować zanieczyszczenie zawartości (patrz ostrzeżenia i środki ostrożności, 5.1).
jednoczesne stosowanie soczewek kontaktowych
pacjentom należy zalecić, aby nie zakładali soczewek kontaktowych, jeśli ich oko jest zaczerwienione. Należy poinformować pacjentów, że do leczenia podrażnień związanych z soczewkami kontaktowymi nie należy stosować 0,05% roztworu Okulistycznego Epinastyny HCl. Pacjentom należy również zalecić usunięcie soczewek kontaktowych przed zakropleniem 0,05% roztworu oftalmicznego Epinastyny HCl.
środek konserwujący w 0,05% roztworze okulistycznym Epinastyny HCl, chlorek benzalkoniowy, może być wchłaniany przez miękkie soczewki kontaktowe. Soczewki można ponownie założyć po 10 minutach od podania roztworu Okulistycznego Epinastyny HCl 0,05%
tylko do stosowania miejscowego do oczu
tylko do stosowania miejscowego do oczu.
tylko Rx
dystrybuowane przez:
Breckenridge Pharmaceutical, Inc.
Berlin, CT 06037
Producent:
PrimaPharma, Inc.
San Diego, CA 92121
Rev: 04/2020
2323 04/20
PRINCIPAL DISPLAY PANEL – 5 mL Bottle Carton
NDC 51991-836-75
Epinastine HCl
Ophthalmic
Solution,
0.05%
FOR USE IN THE
EYES ONLY
sterile
Rx Only
5 mL sterile
breckenridge
A Towa
Company

| EPINASTINE HYDROCHLORIDE epinastine hydrochloride solution/ drops |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Labeler – Breckenridge Pharmaceutical, Inc. (150554335)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| PrimaPharma, Inc. | 079699106 | MANUFACTURE(51991-836) | |
More about epinastine ophthalmic
- Side Effects
- During Pregnancy or Il.
- Dosage Information
- Pricing & Coupons
- w Internecie
- 3 Reviews
- Drug class: leki przeciwhistaminowe i zmniejszające przekrwienie oczu
zasoby konsumenckie
- informacje dla pacjentów
- Epinastyna oftalmiczna (zaawansowane Czytanie)
zasoby profesjonalne
- informacje o przepisywaniu
- Epinastyna (profesjonalne porady dla pacjentów)
inne marki Elestat
powiązane Przewodniki leczenia
- zapalenie spojówek, alergia
oświadczenie lekarskie