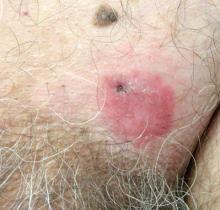
70-letni mężczyzna, u którego w lewym nadżerkowym regionie nie wystąpiła odpowiedź na krem terbinafine 1% po 1 miesiącu leczenia z podejrzeniem tinea cruris. Jego historia medyczna była niezwykła dla nadciśnienia, hiperlipidemii, przewlekłej obturacyjnej choroby płuc, łagodnego rozrostu gruczołu krokowego, tętniaka aorty brzusznej, uzależnienia od alkoholu, zaburzeń używania tytoniu i niezamierzonej utraty wagi o 15 funtów w ciągu ostatniego roku.
diagnoza: Pozamałżeńska choroba Pageta
biopsja płytki ujawniła intraepidermalną proliferację dużych komórek z obfitą jasną cytoplazmą i dużymi jądrami pęcherzykowymi rozmieszczonymi w całym naskórku (ryc. 1). Komórki nowotworowe zabarwione dodatnio zarówno dla okresowej plamy kwasowo-Schiffowej (fig. 2), jak i CK7 (Fig.3). Chemia i panel czynności wątroby, analiza moczu, poziomy antygenu Rakowo -embrionicznego i poziomy antygenu specyficznego dla prostaty mieściły się w zakresie referencyjnym. Morfologia krwi wykazała łagodną niedokrwistość megaloblastyczną. Następnie tomografia komputerowa klatki piersiowej, brzucha i miednicy wykazała tętniaka aorty brzusznej i powiększenie gruczołu krokowego bez żadnych dowodów na potencjalne nowotwory. Kolonoskopia ujawniła liczne polipy hiperplastyczne i gruczolaka kanalikowego. Cystoskopia była prawidłowa, z wyjątkiem objawów powiększenia prostaty. Cytologia moczu była niczym niezwykła. Pacjent został skierowany na wycięcie zmiany za pomocą chirurgii mikrograficznej Mohsa. Zaleca się obserwację co 3 miesiące przez pierwsze 2 lata po operacji, a następnie co 6 miesięcy w celu monitorowania nawrotów lub wtórnych nowotworów.
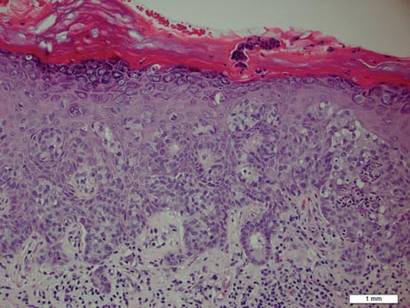
Rysunek 1. Intraepidermalna proliferacja dużych komórek z obfitą przejrzystą cytoplazmą i dużymi jądrami pęcherzykowymi rozmieszczonymi w całym naskórku jako pojedyncze komórki i jako Agregaty komórek o różnej wielkości (H&E, oryginalne powiększenie ×200). (Pasek odniesienia wskazuje 1 mm.)
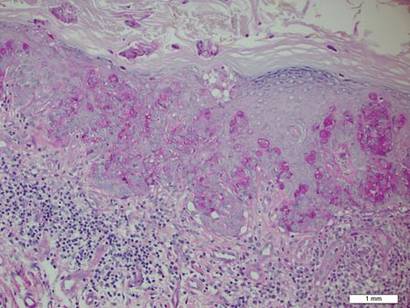
Rysunek 2. Cytoplazma ziarnista była dodatnia na okresowym barwieniu kwasu-Schiffa (pierwotne powiększenie ×200). (Pasek odniesienia wskazuje 1 mm.)
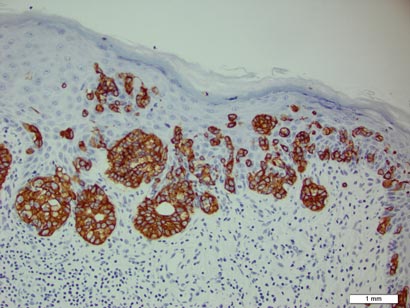
Rysunek 3. Nowotworowe komórki Pageta charakteryzowały się pozytywnym zabarwieniem dla CK7 (pierwotne powiększenie ×200). (Pasek odniesienia wskazuje 1 mm.)
Sir James Paget po raz pierwszy opisał chorobę sutka sutka w 1874 roku w swoim raporcie 15 kobiet z wykwitami skórnymi brodawki sutkowej i otoczki, a następnie rakiem sutka.1 Paget opisał również pacjenta z podobną erupcją na żołędzi prącia, a Crocker2 opisał pozamałżeńską chorobę Pageta (EMPD) moszny i prącia w 1889 roku. Zasadniczą różnicą między chorobą Pageta sutka a EMPD jest lokalizacja anatomiczna.
pozamaciczna choroba Pageta jest rzadką chorobą, która zwykle dotyka pacjentów w wieku od 50 do 80 lat i jest bardziej powszechna u kobiet i ras białoskórych.3 pozamaciczna choroba Pageta często atakuje miejsca skórne, które są bogate w gruczoły apokrynowe. Najczęściej dotknięte miejsce jest srom, a następnie krocza, odbytu, moszny i prącia skóry. Rzadziej mogą mieć wpływ na pachowe, pośladki, uda, powieki i zewnętrzne kanały słuchowe.4
pacjenci z EMPD zwykle występują z dobrze rozgraniczonymi, nierozdzielczymi, rumieniowymi i wypryskami, które mogą mieć związane ze strupowaniem, skalowaniem, wylewami brodawczakowymi, lichenifikacją, owrzodzeniem lub krwawieniem. Najczęstszym objawem jest świąd, a następnie pieczenie, podrażnienie, ból i tkliwość.50% pacjentów jest bezobjawowych. Średni odstęp między wystąpieniem objawów a rozpoznaniem wynosi 2 lata.5
histopatologia ujawnia dyfuzyjnie naciekające, nieregularne, nowotworowe komórki Pageta w obrębie naskórka, które są duże i wakuolowane z obficie bladoniebieską cytoplazmą i dużymi jądrami pęcherzykowymi, które mogą być centralnie lub bocznie ściśnięte. Komórki mogą być rozprowadzane pojedynczo lub w grupach jako nici, gniazda, lub wzorce gruczołowe w dolnej naskórka, grzbiety rete, i struktur przydennych. Hyperkeratosis, acanthosis, i parakeratosis mogą być również obecne. Paget Cells stain for immunohistochemical markers of apocrine and eccrine derivation including low-molecular-weight cytokerat, gross cystic disease fluid protein 15, periodic Acid-Schiff stain and carcinoembryonic antigen.5 Perrotto i wsp. 6 badali 98 próbek od 61 pacjentów i stwierdzili, że CK7 był dodatni we wszystkich próbkach EMPD, podczas gdy ck20 i białko płynne 15 z chorobą pęcherzową były dodatnie w dużych podgrupach zarówno pierwotnego, jak i wtórnego EMPD. Przypadki EMPD wtórnego do gruczolakoraka odbytu były w dużej mierze ujemne dla ERBB2 (dawniej HER2 / neu) i dodatnie dla CDX2.
rozpoznanie EMPD powinno być poprzedzone dokładnym zbadaniem raków. W przeglądzie 197 przypadków EMPD u 24% pacjentów z EMPD stwierdzono współistniejący, in situ lub inwazyjny rak apokrynowy adnexal, który był związany z wyższym wskaźnikiem śmiertelności niż u pacjentów bez tego nowotworu. Dodatkowo, u 12% pacjentów z EMPD stwierdzono współistniejący wewnętrzny nowotwór złośliwy.7 te nowotwory mogą obejmować raka cewki moczowej, pęcherza moczowego, pochwy, szyjki macicy, endometrium, prostaty, okrężnicy i odbytnicy. Empd okołoodbytnicza ma większą częstość występowania nowotworów złośliwych niż EMPD sromu.5 lokalizacja EMPD jest związane z lokalizacją podstawowej nowotworu; na przykład, okołoodbytnicza EMPD jest związane z gruczolakorakiem jelita grubego, i EMPD prącia, moszny i pachwiny jest związane z nowotworów układu moczowo-płciowego. Badania mające na celu poszukiwanie związanych nowotworów u pacjentów z EMPD mogą obejmować ultrasonografię miednicy i/lub rezonans magnetyczny, histeroskopię, kolonoskopię, sigmoidoskopię, cystoskopię, dożylny pyelogram, mammogram i / lub zdjęcie RTG klatki piersiowej.