Kinetyka chemiczna
Kinetyka chemiczna
możesz być zaznajomiony z miareczkowaniem kwasowo-zasadowym, które wykorzystują fenoloftaleinę jako wskaźnik końcowy. Być może nie zauważyłeś, jednak, co się dzieje, gdy rozwiązanie, które zawiera fenoloftaleinę w obecności nadmiaru zasady, może stać przez kilka minut. Chociaż roztwór początkowo ma różowy kolor, stopniowo staje się bezbarwny, ponieważ fenoloftaleina reaguje z jonami OH w silnie zasadowym roztworze.
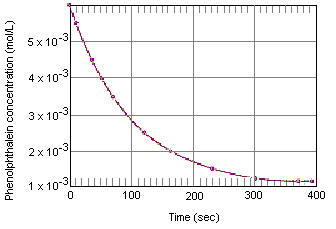
poniższa tabela pokazuje, co dzieje się ze stężeniem roztworu fenoloftaleiny, które początkowo wynosiło 0,005 M w fenoloftaleinie i 0,61 m w jonach OH. Jak widać, gdy dane te są wykreślone na poniższym wykresie, koncentracja fenoloftaleinkoncentracja zmniejsza się o współczynnik 10 w okresie około czterech minut.
Experimental Data for the Reaction Between Phenolphthalein and ExcessBase
| Concentration of Phenolphthalein (M) |
Time (s) | |
| 0.0050 | 0.0 | |
| 0.0045 | 10.5 | |
| 0.0040 | 22.3 | |
| 0.0035 | 35.7 | |
| 0.0030 | 51.1 | |
| 0.0025 | 69.3 | |
| 0.0020 | 91.6 | |
| 0.0015 | 120.4 | |
| 0.0010 | 160.9 | |
| 0.00050 | 230.3 | |
| 0.00025 | 299.6 | |
| 0.00015 | 350.7 | |
| 0.00010 | 391.2 |
eksperymenty takie jak ten, który dał nam dane z powyższej tabeli są klasyfikowane jako pomiary kinetyki chemicznej (od greckiego rdzenia oznaczającego „tomove”). Jednym z celów tych eksperymentów jest opisanie szybkości reakcjiszybkość, z jaką reagenty są przekształcane w produkty reakcji.
termin szybkość jest często używany do opisania zmiany ilościktóre występuje na jednostkę czasu. Na przykład stopa inflacji to zmianaśredniego kosztu kolekcji standardowych przedmiotów rocznie. Szybkość, z jaką obiekt przemierza przestrzeń, to odległość przebyta na jednostkę czasu, na przykład mile na godzinę lub kilometry na sekundę. W kinetyce chemicznej przebyta odległość jest zmianą wkoncentracji jednego ze składników reakcji. Szybkość reakcji jest zatem zmianą stężenia jednego z reagentów![]() (X)
(X)![]() , która występuje w danym okresie czasu
, która występuje w danym okresie czasu![]() t.
t.
![]()
problem praktyczny 1:
użyj danych z powyższej tabeli, aby obliczyć szybkość reakcji fenoloftaleiny z jonami oh w każdym z następujących okresów:
(a) w pierwszym przedziale czasu, gdy stężenie fenoloftaleiny spada z 0,0050 m do 0,0045 M.
(b) w drugim interwale, gdy stężenie spada z 0,0045 M do 0,0040 m.
(c) w trzecim interwale, gdy stężenie spada z 0,0040 m do 0,0035 M.
Kliknij tutaj, aby sprawdzić odpowiedź na zadanie treningowe 1.
Kliknij tutaj, aby zobaczyć rozwiązanie problemu 1.
![]()
chwilowe tempo reakcji i RateLaw dla reakcji
szybkość reakcji między fenoloftaleiną a Jonem OH-nie jest stała; zmienia się w czasie. Podobnie jak większość reakcji, szybkość tej reakcjidualnie zmniejsza się, gdy reagenty są spożywane. Oznacza to, że szybkość reakcji zmienia się podczas pomiaru.
aby zminimalizować błąd, który wprowadza do naszych pomiarów, wydaje się, że zaleca się mierzenie szybkości reakcji w okresach, które są krótkie w porównaniu z czasem, w którym reakcja zachodzi. Możemy na przykład spróbować zmierzyć nieskończenie małą zmianę stężenia![]() d(X)
d(X)![]() , która występuje w nieskończenie krótkim okresie czasu. Stosunek tych ilorazów jest znany jako chwilowa szybkość reakcji.
, która występuje w nieskończenie krótkim okresie czasu. Stosunek tych ilorazów jest znany jako chwilowa szybkość reakcji.
![]()
chwilowa szybkość reakcji w dowolnym momencie można obliczyć z wykresu stężenia reagenta (lub produktu) w stosunku do czasu. Poniższy wykres pokazuje, jak szybkość reakcji rozkładu fenoloftaleiny można obliczyć na podstawie wykresu stężenia w stosunku do czasu. Szybkość reakcji w dowolnym momencie jest równa nachyleniu stycznej narysowanej do tej krzywej w danym momencie.

chwilowa szybkość reakcji może być zmierzona w dowolnym momencie pomiędzy momentem, w którym reagenty są mieszane i reakcja osiąga równowagę.Ekstrapolacja tych danych z powrotem do momentu, w którym odczynniki są mieszane daje początkową szybkość reakcji.
![]()
Prawa i stałe szybkości
ciekawy wynik uzyskuje się, gdy chwilowa szybkość reakcji jest obliczana w różnych punktach wzdłuż krzywej na wykresie w sekcji previous. Szybkość reakcji w każdym punkcie tej krzywej jest bezpośrednio proporcjonalna do stężenia fenoloftaleiny w danym momencie.
szybkość = K(fenoloftaleina)
ponieważ równanie to jest prawem doświadczalnym opisującym szybkość reakcji, nazywa się je prawem szybkości reakcji. Proporcjonalnośćstała, k, jest znana jako Stała szybkości.
zadanie praktyczne 2:
Oblicz stałą szybkości reakcji między fenoloftaleiną a Jonem OH, jeśli chwilowa szybkość reakcji wynosi 2.5 x 10-5 mola na litr na sekundę, gdy stężenie fenoloftaleiny wynosi 0,0025 M.
Kliknij tutaj, aby sprawdzić odpowiedź na zadanie praktyczne 2.
Kliknij tutaj, aby zobaczyć rozwiązanie problemu 2.
zadanie praktyczne 3:
użyj stałej szybkości reakcji między fenoloftaleiną a Jonem OH, aby obliczyć początkową chwilową szybkość reakcji dla danych doświadczalnych wymienionych w poprzedniej tabeli.
Kliknij tutaj, aby sprawdzić odpowiedź na Zadanie 3.
Kliknij tutaj, aby zobaczyć rozwiązanie problemu 3.
![]()
różne sposoby wyrażania szybkości reakcji
zazwyczaj istnieje więcej niż jeden sposób pomiaru szybkości reakcji. Możemy badać rozkład jodowodoru, na przykład, mierząc szybkość, w której H2 lub I2 powstaje w następującej reakcji lub teracie, w którym spożywa się HI.
2 HI(G) H2(g) + I2(G)
doświadczalnie stwierdzamy, że szybkość, z jaką powstaje I2, jest w dowolnym momencie proporcjonalna do kwadratu stężenia HI.
![]()
co by się stało, gdybyśmy zbadali szybkość tworzenia się H2?Zrównoważone równanie sugeruje, że H2 I I2 muszą być utworzone w tym samym tempie.
![]()
Co by się jednak stało, gdybyśmy zbadali szybkość, z jaką HI zużywa się w tej reakcji? Ponieważ HI jest spożywany, zmiana jego stężenia musi być liczbą anegatywną. Zgodnie z konwencją szybkość reakcji jest zawsze podawana jako dodatniumer. Dlatego musimy zmienić znak przed zgłoszeniem szybkości reakcji dla areaktantu, który jest zużywany w reakcji.
![]()
znak ujemny robi dwie rzeczy. Matematycznie przekształca ujemną zmianę w stężeniu HI na dodatnią. Fizycznie przypomina nam, żekoncentracja reagenta maleje z czasem.
Jaka jest zależność między szybkością reakcji uzyskiwanej przez powstawanie H2 lub I2 a szybkością uzyskiwaną przez powstawanie H2 lub I2? Stechiometria reakcji mówi, że dwie cząsteczki HI są zsumowane dla każdej wytworzonej cząsteczki H2 lub I2. Oznacza to, że szybkość rozkładu HI jest dwa razy szybsza niż szybkość, z jaką powstają H2 I I2. Możemy przetłumaczyć tę zależność na równanie matematyczne w następujący sposób.
![]()
w rezultacie Stała szybkości otrzymywana z badania szybkości, z jaką powstają H2 I I2 w tej reakcji (k), nie jest taka sama jak Stała szybkości otrzymywana przez monitorowanie szybkości, z jaką HI jest zużywana (k’)
zadanie praktyczne 4:
Oblicz szybkość, z jaką HI zanika w następującej reakcji w momencie formowania się I2 z szybkością 1,8 x 10-6 moli na litr na sekundę:
2 HI(g) ![]() H2(g) + I2(g)
H2(g) + I2(g)
Kliknij tutaj, aby sprawdzić odpowiedź na ćwiczenie Problem 4.
Kliknij tutaj, aby zobaczyć rozwiązanie problemu 4.
![]()
prawo szybkości a Stechiometria działania
w latach trzydziestych Sir Christopher Ingold i współpracownicy z University oflon badali kinetykę reakcji podstawienia, takich jak poniżej.
CH3Br(AQ) + OH-(AQ)
CH3OH(AQ) + br-(AQ)
do koncentracji obu reagentów.
Rate = K(CH3Br)(OH-)
Kiedy przeprowadzili podobną reakcję na nieco innym materiale startowym, dostali podobne produkty.
(CH3)3CBr(AQ) + OH-(AQ)![]() (CH3)3COH(aq) + Br-(AQ)
(CH3)3COH(aq) + Br-(AQ)
ale teraz szybkość reakcji była proporcjonalna do stężenia tylko jednego z reagentów.
Rate = K((CH3)3CBr)
te wyniki ilustrują ważny punkt: prawa szybkości dla działania nie można przewidzieć na podstawie stechiometrii reakcji; musi być ona określona w sposób doświadczalny. Czasami prawo szybkości jest zgodne z tym, czego oczekujemy od stoichiometrii reakcji.
2 HI(g) H2(g) + I2(g)
Rate = k(HI)2
Often, however, it is not.
| 2 N2O5(g) |
Rate = K(N2O5) |
![]()
kolejność Cząsteczkowości
niektóre reakcje zachodzą w jednym kroku. Reakcja, w której chlorineatom jest przenoszony z ClNO2 do NO tworząc NO2 i ClNO jest dobrym przykładem reakcji jednoetapowej.
ClNO2(g) + NO(g)
NO2(g) + ClNO(g)
Other reactions occur by a series of individual steps. N2O5,for example, decomposes to NO2 and O2 by a three-step mechanism.
| Step 1: | N2O5 |
|
| Krok 2: | NO2 + NO3 |
|
| Krok 3: | no + no3 |
etapy reakcji są klasyfikowane pod względem MOLEKULARNOŚCI,która opisuje liczbę spożywanych cząsteczek. Gdy pojedyncza cząsteczka jest spożywana, krok nazywa się unimolecular. Gdy dwie cząsteczki są zsumowane, jest bimolekularny.
zadanie praktyczne 5:
Określ cząsteczkowość każdego etapu reakcji, w którym N2O5 rozkłada się do NO2 i O2.
Kliknij tutaj, aby sprawdzić odpowiedź na zadanie 5.
Kliknij tutaj, aby zobaczyć rozwiązanie problemu 5.
reakcje można również zaklasyfikować pod względem ich kolejności. Skład N2O5 jest reakcją pierwszego rzędu, ponieważ jej skład zależy od stężenia N2O5 podniesionego do potęgi pierwszej.
szybkość = K(N2O5)
rozkład HI jest reakcją drugiego rzędu, ponieważ szybkość reakcji zależy od stężenia HI podniesionego do drugiej potęgi.
Rate = K(HI)2
gdy szybkość reakcji zależy od więcej niż jednego odczynnika, klasyfikujemy reakcję pod względem kolejności każdego odczynnika.
Problem praktyczny 6:
zaklasyfikować kolejność reakcji między NO i O2 do postaci NO2:
2 NO(g) + O2(g)![]() 2 NO2(g)
2 NO2(g)
przyjąć następujące prawo szybkości dla tej reakcji:
Rate = K(NO)2(O2)
Kliknij tutaj, aby sprawdzić odpowiedź na zadanie treningowe nr 6.
różnica między cząsteczkowością a porządkiem reakcji jest ważna. Cząsteczkowość reakcji,lub etap w reakcji, opisuje to, co dzieje się na poziomie molekularnym. Kolejność reakcji opisuje, co dzieje się w skali makroskopowej. Ustalamy kolejność reakcji obserwując, jak pojawiają się produkty reakcji lub reagenty znikają. Cząsteczkowość reakcji jest czymś, co wydedukowaliśmy, aby wyjaśnić te eksperymentalne wyniki.
![]()
model teorii kolizji reakcji chemicznych
model teorii kolizji reakcji chemicznych może być użyty do określenia obserwowanych praw szybkości zarówno dla reakcji jednoetapowych, jak i wieloetapowych. Model ten zakłada, że szybkość każdego etapu reakcji zależy od częstotliwości kolizji pomiędzy cząstkami uczestniczącymi w tym etapie.
poniższy rysunek stanowi podstawę do zrozumienia implikacji modelu teorii zderzeń dla prostych, jednoetapowych reakcji, takich jak poniższe.
ClNO2(G) + NO(G)![]() NO2(G) + ClNO(g)
NO2(G) + ClNO(g)

kinetyczna teoria molekularna zakłada, że liczba zderzeń w gazie zależy od liczby cząstek na litr. Szybkość powstawania NO2 i ClNO w tej reakcji powinna być zatem wprost proporcjonalna do koncentracji zarówno ClNO2, jak i NO.
szybkość = K(ClNO2)(NO)
Model teorii zderzeń sugeruje, że szybkość dowolnego etapu działania jest proporcjonalna do stężenia odczynników zużywanych w tym etapie. Prawo jednoetapowej reakcji powinno zatem zgadzać się ze stechiometrią tej reakcji.
następująca reakcja zachodzi na przykład w jednym kroku.
CH3Br(AQ) + OH-(AQ)![]() CH3OH(aq) + Br-(AQ)
CH3OH(aq) + Br-(AQ)
gdy cząsteczki te zderzają się we właściwej orientacji, para elektronów na Jonie OH może zostać przekazana do atomu węgla w centrum cząsteczki CH3Br, jak pokazano na rysunku poniżej.
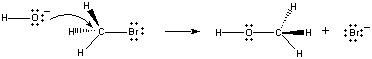
gdy tak się dzieje, powstaje Wiązanie węgiel-tlen w tym samym czasie, w którym Wiązanie węglowo-bromowe jest zerwane. Wynikiem tej reakcji jest podstawienie jonu anOH na jon Br. Ponieważ reakcja zachodzi w układzie pojedynczym, który obejmuje zderzenia między dwoma reagentami, szybkość tej reakcji jest proporcjonalna do stężenia obu reagentów.
Rate = K(CH3Br)(OH -)
nie wszystkie reakcje zachodzą w jednym kroku. Następująca reakcja zachodzi wtrzy etapach, jak pokazano na rysunku poniżej.
(CH3)3CBr(AQ) + OH-(AQ)![]() (CH3)3COH(aq) + Br-(AQ)
(CH3)3COH(aq) + Br-(AQ)
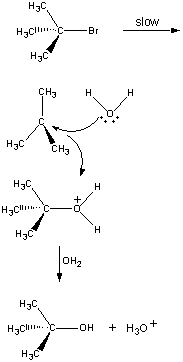
w pierwszym kroku (CH3)3cbr cząsteczkispołącza się w parę jonów.
| pierwszy krok | 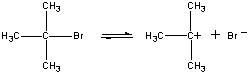 |
dodatnio naładowany (CH3)jon 3C+ oddziałuje następnie z wodą w drugim kroku.
| drugi krok | 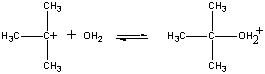 |
produkt tej reakcji traci wtedy Proton na rzecz jonu Oh lub wody w końcowym etapie.
| Trzeci krok | 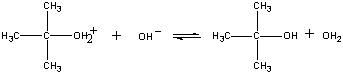 |
drugi i trzeci etap tej reakcji jest znacznie szybszy niż pierwszy.
| (CH3)3CBr |
Slow step | |
| (CH3)3C+ + H2O |
Fast step | |
| (CH3)3COH2+ + OH- |
Fast step |
The overall rate of reaction is therefore more or less equal to the rateof the first step. Pierwszy etap jest zatem nazywany etapem ograniczającym szybkośćw tej reakcji, ponieważ dosłownie ogranicza szybkość, z jaką produkty reakcji mogą być tworzone. Ponieważ tylko jeden odczynnik jest zaangażowany w etap ograniczający szybkość, ogólny współczynnik reakcji jest proporcjonalny do stężenia tylko tego odczynnika.
Rate = K((CH3)3CBr)
prawo szybkości dla tej reakcji różni się zatem od tego, czego chcielibyśmy się spodziewać po stechiometrii reakcji. Chociaż reakcja pochłania zarówno(CH3)3CBR OH-, szybkość reakcji jest tylko proporcjonalna do stężenia (CH3)3CBR.
prawa szybkości reakcji chemicznych można wyjaśnić następującymi zasadami ogólnymi.
szybkość dowolnego etapu reakcji jest wprost proporcjonalna do stężenia reagentów zużywanych w tym etapie.
ogólne prawo szybkości reakcji określa się przez sekwencję etapów lub mechanizm, za pomocą którego reagenty są przekształcane w produkty reakcji.
ogólne prawo szybkości reakcji jest zdominowane przez prawo szybkości dla najwolniejszego etapu reakcji.