Zidentyfikuj najbardziej kwaśny H
metodyczne podejście działa najlepiej. Mówiąc najprościej, musisz przeskanować cząsteczkę w poszukiwaniu kwaśnych grup funkcyjnych, a następnie uporządkować reaktywność tych grup. Najbardziej kwaśną grupą funkcyjną jest zwykle trzymanie najbardziej kwaśnego H w całej cząsteczce.
„Scan and rank” brzmi prosto, ale ukrywa kilka trudności, które są opisane poniżej.
skanowanie cząsteczki pod kątem znanych kwaśnych grup czynnościowych
kwaśne protony zwykle wiążą się z O lub N. Dlatego pierwszym krokiem jest poszukiwanie wszystkich wiązań OH I NH.
jednak, gdy zlokalizujesz wiązania OH I NH, będziesz musiał zdecydować, czy te połączone Atomy powinny być połączone w grupę funkcyjną z sąsiednimi atomami.
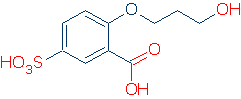
jedyną wygodną metodą identyfikacji grupy funkcjonalnej jest poznanie jej. Na przykład, jeśli wiesz, że ROH, RCO2H i RSO3H są typowymi kwasowymi grupami czynnościowymi, nie będziesz miał problemu ze znalezieniem grup kwaśnych w następującej cząsteczce (właściwe grupy są oznaczone na Czerwono).
Ranga kwasowości OH I NH osobno
wartości pKa wspólnych kwasów OH I NH obejmują szerokie zakresy, a ich zakresy pokrywają się. Ranking przebiega szybciej, jeśli klasyfikujesz kwasy OH I NH osobno, a następnie porównujesz najlepszych kandydatów w każdej kategorii.
najwygodniejszą metodą klasyfikacji grup kwaśnych jest poznanie ich charakterystycznych wartości pKa. Jeśli znasz te wartości dla wszystkich grup kwasowych w Twojej cząsteczce, to grupa o najniższym pKa zawiera najbardziej kwaśny H. przypadek zamknięty.
Jeśli nie pamiętasz wartości pKa dla wszystkich grup kwasowych, kilka ogólnych zasad może cię poprowadzić.
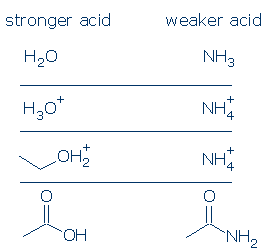
#1 Znaczenie – kwasy naładowane dodatnio są silniejsze niż kwasy obojętne. Ujemnie naładowane kwasy rzadko są kwaśne. Jeśli porównasz wartości pKa zwykłych kwasów OH, zobaczysz, że kwasy ROH2+ (w tym H3O+ i R2OH+) są znacznie silniejsze niż kwasy obojętne, takie jak RCO2H, PhOH i ROH. Jedynymi kwasami neutralnymi, które są silniejsze od ROH2+ są H2SO4 i niektóre inne RSO3H.
formalna reguła ładunku ma jeszcze silniejsze zastosowanie do kwasów NH. Różnica w pKa między H3O+ i H2O wynosi 18 jednostek, podczas gdy różnica w PKA między NH4+ i NH3 to gigantyczne 26 jednostek.
#2 Znaczenie – Szukaj grup aktywujących, w tym RSO2, RC=O i pH.Poniższy wykres pokazuje, jak każda grupa atomów aktywuje kwas OH (wartości pKa wahają się od 16 do -2):
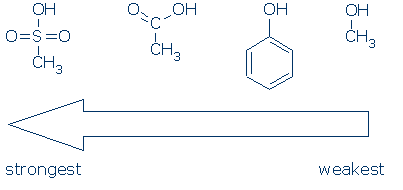
CH3 jest uważany za grupę obserwatora, gdziekolwiek występuje w tych cząsteczkach. Jest niepolarny i nie wywiera znaczącego efektu indukcyjnego pola i nie jest w stanie delokalizować ładunku. W związku z tym możliwe jest zastąpienie CH3 innymi grupami obserwacyjnymi (na przykład H i innymi R) bez większego wpływu na reaktywność.
należy zwrócić uwagę na dwie dodatkowe kwestie dotyczące aktywacji grup.
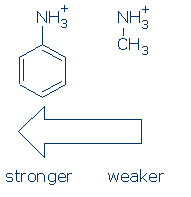
Po pierwsze, grupy wywierają podobny wpływ na kwasy NH (A Sekwencja aktywująca jest taka sama: RSO2> RC=O> Ph). Tak się składa, że musisz tylko nauczyć się wpływu Ph na NH+ na ten kurs:
Po Drugie, grupy aktywujące muszą być połączone bezpośrednio z grupą OH (lub NH), aby ją aktywować. Następujące związki mają podobne wartości pKa, ponieważ grupy aktywujące nie są związane bezpośrednio z OH: CH3C (=o)CH2OH, PhCH2OH i CH3CH2OH.
#3 Znaczenie-wszystko jest równe, kwas OH jest bardziej kwaśny niż kwas NH. Zasada ta może być bardzo przydatna, jeśli jest właściwie stosowana. Obawiam się, że rozumiecie, co rozumiecie przez „wszystkie rzeczy są równe.”Oznacza to, że O I N muszą mieć ten sam ładunek formalny (punkt #1) i muszą być powiązane z tą samą grupą aktywującą (punkt #2). Różnice w grupach widza nie mają jednak znaczenia.
niektóre poprawne porównania obejmują:
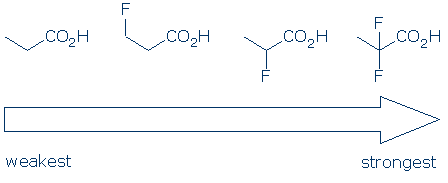
#4 znaczenie – w ramach kategorii grup funkcjonalnych, użyj podstawników do porównania kwasów. Podstawniki elektroujemne zwykle zwiększają kwasowość grupy funkcyjnej poprzez połączenie efektów polowych i indukcyjnych. Efekty te są nasilone, gdy 1) podstawnik znajduje się bliżej grupy kwasowej i 2) Istnieje wiele podstawników. Biorąc pod uwagę te zasady, oczekujemy, że kwasowość tych kwasów karboksylowych podąży tym trendem: