A Microbial Biorealm page on the genus Citrobacter freundii
Classification
Higher order taxa
Bacteria; Proteobacteria; Gammaproteobacteria; Enterobacteriales; Enterobacteriaceae; Citrobacter
Species
NCBI: Taxonomy
Citrobacter Freundii
Description and significance
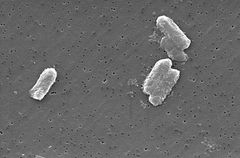 Photo: Pete Wardell/ CDC
Photo: Pete Wardell/ CDC
speciile Citrobacter, inclusiv Citrobacter freundii, sunt bacili gram-negativi aerobi. Citrobacter freundii sunt bacterii lungi în formă de tijă, de obicei cu lungimea de 1-5 unqqm . Majoritatea celulelor C. freundii sunt înconjurate de mulți flageli folosiți pentru a se deplasa, dar câțiva sunt non-motili. Habitatul său include mediul (sol, apă, canalizare), alimente și tracturile intestinale ale animalelor și oamenilor . Acesta aparține familiei Enterobacteriaceae.
ca agent patogen oportunist, C. freundii este responsabil pentru o serie de infecții oportuniste semnificative. Se știe că este cauza unei varietăți de infecții nosocomiale ale tractului respirator, ale tractului urinar, ale sângelui și ale altor câteva locuri sterile în mod normal la pacienți . C. freundii reprezintă aproximativ 29% din toate infecțiile oportuniste . Prin urmare, unul dintre principalele motive pentru care multe tulpini și plasmide diferite ale genomului C. freundii sunt secvențiate este pentru a găsi antibiotice care pot combate aceste infecții oportuniste.în mod surprinzător ,acest microb infecțios la om joacă un rol pozitiv în mediul înconjurător. C. freundii este responsabil pentru reducerea nitratului la nitrit în mediu . Această conversie crucială este o etapă importantă în ciclul azotului. Și reciclarea azotului este foarte esențială, deoarece atmosfera pământului este de aproximativ 85% azot . Prin urmare, datorită contribuției sale importante la mediu este o altă motivație pentru secvențierea genomului lui C. freundii.
genul Citrobacter a fost descoperit în 1932 de Werkman și Gillen. Culturile de C. freundii au fost izolate și identificate în același an din extracte de sol .
structura genomului
nicio informație despre genomul complet al C. freundii nu este disponibilă online, deși unele tulpini individuale și plasmide ale microbului au fost secvențiate. Cea mai proeminentă este plasmida pCTX-M#3, deoarece este cea mai mare plasmidă și codifică o cantitate mare de proteine. Secvența sa a fost finalizată la 6 ianuarie 2005. Este o plasmidă ADN circulară și are o lungime de 89.468 perechi de baze nucleotidice. Lungimea plasmidei este de 0,089468 (Mbp). Este compus din 51,0% conținut de GC și codifică 105 proteine .
o altă caracteristică importantă a C. genomul freundii este că este singurul microb din familia Enterobacteriaceae care conține o plasmidă care codifică L-metionină-liză (MGL). Secvența nucleotidică a plasmidei conține o inserție EcoRI lungă de 3000 bp . Fragmentul conține, de asemenea, două cadre de citire deschise. Primul cadru este format din 1.194 nucleotide, iar al doilea, 1.296 nucleotide.Primul cadru, cunoscut sub numele de gena megL, codifică o proteină de 398 de reziduuri de aminoacizi care are omologie de secvență cu MGL-uri din diferite surse. Al doilea cadru codifică o proteină cu omologie de secvență cu proteine aparținând familiei permeazelor .
gena C. freundii OS60 AMPc-lactamază a fost, de asemenea, secvențiată și este compusă din 1197 nucleotide. Codifică un precursor lung de aminoacizi 380 și conține o peptidă semnal de reziduuri 19 în capătul 5′. Această genă codifică o proteină matură care are o masă moleculară de 39 781 Daltoni. Pozițiile aminoacizilor din acești precursori sunt suprisinlgy identice cu reziduurile din E. coli K12 cromozomiale AMPc-lactamaze .
o altă tulpină importantă în genomul C. freunii este GN346, care este un izolat clinic recuperat în 1965. Această tulpină produce enzima cefalosporinază, care are capacitatea de a hidroliza și inactiva cefalosporinele și cephamicinele anibitoice . Regiunile structurale și promotor ale genei cefalosporinazei au o lungime de 1408 nucleotide. Secvența de aminoacizi a enzimei mature este compusă din 361 aminoacizi cu o masă moleculară de 39.878 Da .
structura celulară și metabolismul
structura celulară a lui C. freundi este lungă și în formă de tijă, de obicei, de 1-5 mm lungime. Exteriorul celulei conține multe flageluri folosite pentru motalitate . Deoarece C. freundii este o bacterie gram-negativă, conține două membrane (interioare și exterioare).Spațiul periplasmic se află între cele două membrane. Membrana exterioară nu conține o sursă de energie; dar conține multe porine încorporate în interior care ajută organismul să dobândească ioni importanți . Spre deosebire de bacteriile gram-pozitive, celulele C. freundii nu conțin un perete celular gros format din peptidoglican. pentru metabolism, C. freundii are o capacitate uimitoare de a crește pe glicerol ca sursă unică de carbon și energie. În acest proces, glicerolul este fermentat printr-un proces de dezmembrare. Acest proces necesită două căi . În prima cale, glicerolul este dehidrogenat de o glicerol dehidrogenază legată de NAD1 la dihidroxiacetonă. Dihidroxiacetona este apoi fosforilată și canalizată la glicoliză prin dihidroxiacetonă kinază . În a doua cale, glicerolul este deshidratat de coenzima B12-glicerol dependent dehidratază pentru a forma 3-hidroxipropionaldehidă . Acest produs este redus la produsul principal de fermentație 1,3-propandiol prin 1,3-propandiol dehidrogenaza legată de NADH, care regenerează NAD1. Regulonul dha codifică cele patru enzime esențiale ale acestor două căi. Uimitor, expresia regulonului dha este indusă numai atunci când glicerolul este prezent .
celulele C. freundii sunt, de asemenea, capabile să metabolizeze lactoza sau citratul ca sursă de carbon .
Ecologie
Citrobacter freundii se găsesc frecvent în mediu, în principal în sol, apă și canalizare. Ele sunt un indicator al contaminării potențiale a apei. Ele se găsesc, de asemenea, pe diferite organe ale animalelor bolnave, inclusiv mamifere, păsări, reptile și amfibieni . Nu se știe că interacționează cu alte organime. în mediu, C. freundii poate transforma nitratul sau ionul de amoniu (care este un atom de azot combinat cu patru atomi de hidrogen) în nitrit; această reacție are loc atât în mediu, cât și în tractul digestiv al oamenilor și al altor animale . După ce transformă nitratul în nitrit în mediu, nitritul este transformat în azot, iar această etapă finală completează ciclul azotului din atmosfera pământului, care este alcătuit din 85% azot . Rolul ecologic al acestui organism nu numai că include rolul său important în ciclul azotului, deoarece poate acumula și uraniu (care este materialul de bază pentru tehnologia nucleară) prin construirea complexelor fosfatice . Citrobacter freundii a fost, de asemenea, investigat pentru biodegradarea acidului tanic utilizat în tannerys .
patologie
ca agent patogen oportunist, Citrobacter freundii este adesea cauza unor infecții oportuniste semnificative, ceea ce înseamnă că, în general, nu provoacă boli la gazdele umane sănătoase. Acestea afectează doar pacienții cu un sistem imunitar slab, ceea ce înseamnă că au nevoie de o „oportunitate” de a infecta persoana . Prin urmare, la pacienții cu un sistem imunitar suprimat, se știe că speciile de Citrobacter provoacă o mare varietate de infecții nosocomiale ale tractului respirator, ale tractului urinar și ale sângelui . Boala hepatică, biliară și pancreatică sunt, de asemenea, boli comune care sunt cauzate de C. freundii. Tractul biliar este cel mai frecvent loc de infecție de către bacilii C. freundii .
o boală fatală cu care a fost asociată C. freundii este meningita neonatală. Meningita neonatală este inflamația meningelor (sistemul membranelor care înconjoară SNC) din cauza invaziei bacteriene . Rata mortalității meningitei Citrobacter este inacceptabil de mare, ratele de deces ale pacienților variind de la 25 la 50 %. Mai mult, problemele neurologice grave persistă încă la 75% dintre supraviețuitori. În această boală, Citrobacter freundii este capabil să pătrundă în bariera hematoencefalică care constă din epiteliul plexului coroid și endoteliul capilar al creierului .
teste efectuate de Badger et. al în articolul „Citrobacter freundii invadează și se reproduce în celulele endoteliale microvasculare ale creierului uman”sugerează că proliferarea bacteriană a C. freundii are loc la nivel intracelular, ceea ce a fost contrar gândirii științifice generale. Constatările indică faptul că C. freundii traversează vacuolele, se replică și este eliberat în partea bazolaterală a celulelor endoteliale microvasculare ale creierului uman (HBMEC) pentru a traversa bariera hematoencefalică. Analiza ulterioară poate permite strategii terapeutice pentru tratarea infecțiilor. Nu există încă un tratament terapeutic disponibil .
anumite boli studiate la păstrăv și ciprinide sunt, de asemenea, cauzate de C. freundii. C. freundii provoacă modificări inflamatorii anormale în intestinul păstrăvului și modificări inflamatorii și necrotice în organele interne ale ciprinidelor. Boala a fost descoperită prin infecție artificială cu o cultură pură de C. freundii. Această descoperire a stabilit C. freundii ca o cauză a bolii peștilor .
într-un studiu de caz realizat de Journal of Medical Microbiology, un pacient a dezvoltat peritonită și infecție prin tunel din cauza Citrobacter freundii, care este mai puțin frecventă. Pacientul a fost supus dializei peritoneale ambulatorii continue. De obicei, agenții cauzatori sunt microorganisme gram-pozitive, în special Staphylococcus aureus și Staphyloccus edpidermis. De asemenea, nu există rapoarte cunoscute de infecție tunel din cauza C. freundii. Terapia inițială cu antibiotice nu a funcționat și infecția a continuat să persiste până când cateterul a fost îndepărtat. Acest lucru este semnificativ din punct de vedere clinic, deoarece Citrobacter Freundii prezintă o susceptibilitate diferită la antibiotice, motiv pentru care terapia inițială nu a avut succes. Pacientul nu a răspuns la tratament până când cateterul nu a fost îndepărtat, arătând că Citrobacter freundii sunt agenți patogeni oportuniști care afectează pacienții spitalizați și imunocompromiși .
aplicarea la biotehnologie
în industria biotehnologiei, Citrobacter freundii produce multe enzime importante.Primele enzime pe care le produce sunt fosfataza. Activitatea fosfatazei C. freundii a fost postulat a fi implicat în acumularea de plumb, care poate avea un rol important în industria biotehnologiei. S-a descoperit, de asemenea, că activitatea fosfatazei C. freundii are rezistență la unii reactivi de diagnostic .
purificarea și caracterizarea selenocisteinei beta-lyase bacteriene, o enzimă care catalizează în mod specific scindarea L-selenocisteinei la L-alanină, a fost purificată din Citrobacter freundii. Enzima este monomerică cu o greutate moleculară de ca. 64000 și conține 1 mol de 5′-fosfat piridoxal ca cofactor per mol de enzimă. Enzima catalizează, de asemenea, eliminarea alfa, beta a beta-cloro-L-alaninei pentru a forma NH3, piruvat .
tulpinile C. Freundii poartă, de asemenea, o plasmidă care codifică cefalosporinaza AmpC de clasa 1. Aceste enzime pot hydrolzye inactiva noi cephamycins și cefalosporine .
cercetări curente
o cercetare la scară mică privind anumite tulpini de C. freundii a fost făcută recent la Universitatea din Tennessee, Knoxville. Importanța anumitor gene de rezistență la tetraciclină și streptomicină și integroni de clasa 1 în C. au fost evaluate freundii izolate din solul fermei de lapte și solurile nondairy. O tulpină de C. freundii extrasă din solurile fermelor lactate transporta integroni de clasa 1 cu diferite casete genetice inserate. Rezultatele acestui mic studiu au sugerat că prezența mai multor gene de rezistență și integroni de clasa 1 în C. freundii în solul fermei de lapte poate acționa ca un rezervor de gene de rezistență antimicrobiană și ar putea juca un rol în diseminarea acestor gene de rezistență antimicrobiană către alte comunități microbiene comensale și indigene din sol. Cu toate acestea, sunt necesare studii suplimentare pe termen lung efectuate în mai multe locații pentru a susține această ipoteză .o a doua cercetare concerning C. freundii a fost făcută pentru a elabora o metodă de reacție în lanț a polimerazei (PCR) care utilizează simultan trei perechi de primeri specifici pentru a detecta genele anumitor microbi (inclusiv C. freundii). Metoda a inclus proiectarea a trei perechi de grunduri care au fost: SPVC-1 și SPVC-2, INVA-1 și INVA-2; și VIAB-1 și VIAB-2. PCR a fost efectuat folosind acești trei primeri pentru a identifica 14 organisme bacteriene importante din punct de vedere clinic. Următoarele tulpini au fost identificate rapid folosind PCR: (1) C. freundii; (2) S. Typhi; și S. Paratyphi C; (3) S. Dublin (antigen de virulență pozitiv); și (4) serovari de Salmonella care adăpostesc o plasmidă de virulență de tip spv. Deși această metodă PCR este nouă, odată cu avansarea tehnologiei în viitor, această metodă poate permite identificarea imediată a C. freundii la mamifere, astfel încât tratamentul antibiotic adecvat să poată fi inițiat fără întârziere .un al treilea studiu concerning C. freundii a fost realizat la Universitatea din Barcelona, Spania. Au fost studiate mecanismele de rezistență la fluorochinolone la două tulpini de Citrobacter freundii. Ambele tulpini au fost izolate de la același pacient. Acest studiu a permis caracterizarea parțială a genelor acrA și acrB ale acestui microorganism. Expresia genelor la ambele tulpini a fost analizată folosind microarrays ADN pentru Escherichia coli. Similitudinea nucleotidică între genele acrA și acrB parțial secvențiate ale C. freundii și E. coli a fost de 80,7% și, respectiv, 85%. Genele acrA și acrB ale lui C. freundii sunt similare cu cele din E. coli și supraexprimarea lor pot juca un rol important în modularea concentrației finale minime inhibitoare a fluorochinolonelor .
un al patrulea studiu privind C. freundii a fost realizat în Taiwan. O echipă de cercetători a izolat un pacient diabetic care a dezvoltat fasciita necrotizantă care a fost cauzată de C. freundii dintr-o vătămare incitată de un animal marin. Fasciita necrotizantă este o infecție în stratul mai profund al pielii și al țesuturilor subcutanate. La tratarea pacientului au luat o probă din lichidul din rană și au găsit C. freundii. După trei zile de la începerea tratamentelor antibiotice cu cefotaxmină și cefepmină, s-a acumulat abcese subcutanate. După 6, 10, 14 și 21 de zile de îngrijire a pacientului, unele antibiotice îi dădeau pacientului o oarecare ușurare, dar nu s-a ajuns la o recuperare pe termen lung. Cefotoaxima, cefepima, ciprofloxamina sunt printre antibioticele care nu au fost potrivite pentru C. freundii. Pacientul și-a revenit complet după 42 de zile de tratament cu ertapenem. Cercetătorii au izolat două colonii de C. freundii în termen de 5 zile unul de celălalt. Pe măsură ce izolatele au fost crescute, au devenit extrem de rezistente la Cefotaximă și cefepimă. Motivul pentru care entrapenem a lucrat împotriva C. freundii se datorează faptului că este activ împotriva Enterobacteriaceae producătoare de AmpC .
rezistența la antibiotice
speciile de Citrobacter sunt o cauză comună a infecțiilor nosocomiale asociate pacienților care urmează tratamente spitalicești prelungite. S-a raportat recent că C. freundii exprimă rezistență la antibiotice cu spectru larg, inclusiv piperacilină, piperacilintazobactam, vancomicină și cefalosporine. Izolarea Citrobacter freundii rezistent la ceftriaxonă (CRCF) a fost asociată cu antibioticele cu spectru larg supraprescrise. Noile tulpini CRCF emergente ar putea sugera inducerea sau depresia genelor de rezistență, precum și eliminarea organismelor concurente. CRCF a fost izolat în cea mai mare parte de la pacienți cu comorbidități semnificative, inclusiv SIDA, boli vasculare periferice și boli cerebrovasculare. Utilizarea fluorochinolonei a fost, de asemenea, raportată că nu afectează izolarea CRCF .Citrobacter freundii este, de asemenea, cunoscut pentru a conține în cromozomul său o genă care codifică cefalosporinaza. Această enzimă hidrolizează− Co-NH-legătura în inelul lactamic al cefalosporinelor și cephamycis făcând astfel bacteriile rezistente la acest tip de antibiotice. Cu toate acestea, atunci când a fost expus la cefeme și cerbapeneme noi de a treia generație, C. freundii izolat clinic a arătat sensibilitate la aceste substanțe.Un mic focar de C. freundii rezistent la cephems de generația a treia a fost observat în secția chirurgicală a Spitalului Universitar Nagoya la pacienții care au suferit proceduri chirurgicale. C. freundii a fost izolat de bila pacientului, tifon, fecale, puroi și ascită. S-a sugerat că aceste noi tulpini de C. freundii conțin o plasmidă care codifică Celfalosporinaza AmpC, dar la eșecul transferului rezistenței cefemelor de la C. freundii la E. coli s-a concluzionat că enzima trebuie codificată în cromozomul C. freundii. Deoarece C. freundi este asociat cu infecții nosocomiale se recomandă prudență la aceste noi tulpini .
1. Wang JT, Chang SC, Chen YC, Luh KT. „Compararea susceptibilității antimicrobiene a Citrobacter freundii izolate în două perioade de timp diferite.”Jurnalul de microbiologie, imunologie și infecție. 2000 Decembrie; 33 (4): 258-62.
2. Whalen JG, Mully TW, Enlgish JC 3rd. „Infecție spontană cu Citrobacter freundii la un pacient imunocompetent.”Arhivele Dermatologiei. 2007 ianuarie; 143 (1): 124-5.
3. Puchenkova SG. „Enterobacterii în zonele de apă de-a lungul coastei Crimeei.”Mikrobiolohichny Zhurnal de la sută. 1996 Mar-Aprilie; 58(2): 3-7.
4.http://www.ncbi.nlm.nih.gov/sites/entrez?db=genomeprj&cmd=Retrieve&dopt=Overview&list_uids=13123
5. Ilya V. Manukhov, Daria V. Mamaeva, Serghei M. Rastorguev, Nicolai G. Faleev, Elena A. Morozova, Tatyana V. Demidkina și Gennadii B. Zavilgelsky. „O genă care codifică l-metionina-Laza este prezentă în genomii familiei Enterobacteriaceae: identificarea și caracterizarea Citrobacter freundii l-metionina-Laza.”Jurnalul de Bacteriologie. 2005 iunie; 187 (11): 3889-3893.
6. Lindberg, Frederik; Westman, Lennart; Normark, Staffan. „Componente de reglementare în inducerea Citrobacter freundii AMPc-lactamază.”Lucrările Academiei Naționale de științe din Statele Unite ale Americii. 1985 iulie; 82 (14): 4620-4624.
7. Tsukamoto K, Tachibana K, Yamazaki n, Ishii Y, Ujii K, Nishida n, Sawai T. „rolul lizinei-67 în situsul activ al beta-lactamazei din clasa C din Citrobacter freundii GN346.”Jurnalul European de Biochimie / FEBS. 1990 22 februarie; 188 (1): 15-22.
8. Keevil CW, Hough JS, Cole JA. „Creșterea prototrofică a Citrobacter freundii și baza biochimică pentru cerințele sale aparente de creștere în mediile aerate.”Jurnalul de Microbiologie generală. 1997 ianuarie; 98 (1): 273-6.
9. Marco s-a născut în secolul al XIX-lea, în secolul al XX-lea, în secolul al XX-lea, în secolul al XX-lea, în secolul al XX-lea, în secolul al XX-lea, în secolul al XX-lea, în secolul al XX-lea. „Fatal Citrobacter freundii bronhopneumonie dobândită în Comunitate la un pacient fără compromisuri.”Revista Cl. 1985 Aprilie; 176 (6): 320
10. Julie L. Badger, Monique F. Stins și Kwang Sik Kim. „Citrobacter freundii invadează și se reproduce în celulele endoteliale microvasculare ale creierului uman.”Hinyokika kiyo. Acta Urologica Japonica. 1985 iulie; 31 (7): 1159-70.
11. Drelichman V, trupa JD. „Bacteremii datorate Citrobacter diversus și Citrobacter freundii. Incidența, factorii de risc și rezultatul clinic.”Arhivele de Medicină Internă. 1985 octombrie; 145 (10): 1808-10.
12. Srinivasan V, Nam HM, Sawant AA, Headrick SI, Nguyen LT, Oliver SP. „Distribuția genelor de rezistență la tetraciclină și streptomicină și a Integronilor de clasa 1 în Enterobacteriaceae izolate din solul fermei lactate și Nedairy.”Ecologie Microbiană. 2007 August 15.
13. S-X-X-X-X-X-X, Vila J. ” caracterizarea parțială a locusului acrAB în două izolate clinice Citrobacter freundii.”Jurnalul Internațional al agenților antimicrobieni. 2007 septembrie; 30 (3): 259-63.
14. Ci oktserci IH, Korcan SE, Konuk M, OZT Oktsrk S. „Compararea activităților ALAD ale tulpinilor Citrobacter și Pseudomonas și utilizarea lor ca biomarker pentru contaminarea cu Pb.”Monitorizarea și evaluarea mediului. 2007 22 mai.
15. Chocat P, Esaki N, Tanizawa K, Nakamura K, Tanaka H, Soda K. „purificarea și caracterizarea selenocisteinei beta-lyase din Citrobacter freundii.”Jurnalul de Bacteriologie. 1985 August; 163 (2): 669-76.
16. Hillel S Levinson, Inga Mahler. „Activitatea fosfatazei și rezistența la plumb în Citrobacter freundii și Staphylococcus aureus.”Scrisori de Microbiologie FEMS. 1998 Aprilie; 161 (1): 135-138.
17. Murakami K, Yoshida T. ” legarea covalentă a moxalactamului la cefalosporinaza Citrobacter freundii.”Agenți antimicrobieni și chimioterapie. 1985 Mai; 27 (5): 727-32.
18. Dervisoglu, E., Yegenaga, I., Yumuk, Z. ” peritonita Citrobacter Freundii și infecția tunelului la un pacient cu dializă peritoneală ambulatorie continuă.”Jurnalul de Microbiologie medicală, 2008. Volumul 57. p. 125-127.
19. Kim PW, Harris AD, Roghmann MC, Morris JG Jr, Strinivasan A, Perencevich EN. „Factorii de risc epidemiologic pentru izolarea Citrobacter freundii rezistent la ceftriaxonă versus susceptibil la pacienții spitalizați” agenți Antimicrob Chemother, 2003 Sep;47(9): p.2882-2887.
20. Nada T, Baba H, Kawamura K, Ohkura T, Torii K, Ohta M. „un mic focar de infecție cu Citrobacter freundii rezistentă la cephem de generația a treia pe o secție chirurgicală” Jpn J infectează Dis. 2004 August;57 (4): p.181-182.
21. Chuang, Y., Tseng, S., Teng, L., Ho, Y. și Hsueh, P. „Apariția rezistenței la cefotaximă în citrobactor freundii provocând fasciită necrotizantă și osteomielită” Journal of Infection, 2006. Volumul 53. p. e161-e163.
22.Badger, J., Stins, M. și Sik Kim, K.” Citrobacter freundii invadează și se reproduce în celulele endoteliale microvasculare ale creierului uman ” infecție și imunitate, 1999. Volum67. P. 4208-4215.
editat de Sumaira Akbarzada, student al Rachel LarsenEdited de Greg Vargas și Darren Zhen ,studenți ai m Glogowskiat Loyola UniversityEdited de Gergana Grigorova și Michal Olszewski, studenți ai m Glogowskiat Loyola UniversityEdited de Alex Kula și Joanna Aiken, studenți ai m Glogowskiat Loyola University