dipoler
för att förstå arten av icke-kovalenta interaktioner måste vi först återgå till kovalenta bindningar och gräva i ämnet dipoler. Många av de kovalenta bindningarna som vi har sett – mellan två kol, till exempel, eller mellan ett kol och ett väte –involverar ungefär lika stor delning av elektroner mellan de två atomerna i bindningen. I dessa exempel har de två atomerna ungefär samma elektronegativitet. Minns från din allmänna kemikurs att elektronegativitet hänvisar till” kraften hos en atom i en molekyl för att locka elektroner till sig själv ” (Detta är definitionen som erbjuds av Linus Pauling, den framstående 20-talets amerikanska kemist som var främst ansvarig för att utveckla många av de bindningskoncept som vi har lärt oss).
men ganska ofta i organisk kemi handlar vi om kovalenta bindningar mellan två atomer med olika elektronegativiteter, och i dessa fall är delningen av elektroner inte lika: den mer elektronegativa kärnan drar de två elektronerna närmare. I kol-syrebindningen av en alkohol, till exempel, hålls de två elektronerna i sigmabindningen närmare syre än de är till kolet, eftersom syre är betydligt mer elektronegativt än kol. Detsamma gäller för syre-vätebindningen, eftersom väte är något mindre elektronegativt än kol och mycket mindre elektronegativt än syre.
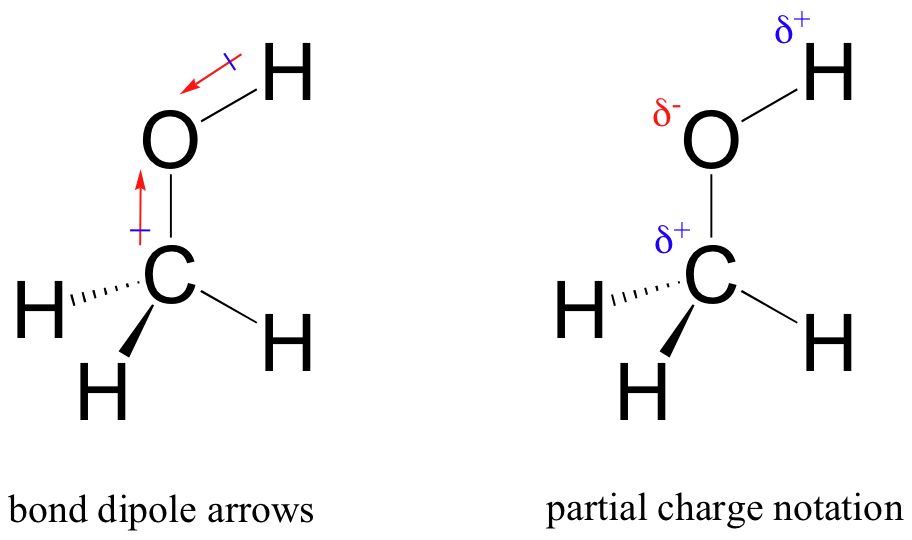
resultatet av denna ojämlika delning är vad vi kallar en bindningsdipol, som finns i en polär kovalent bindning. En bindningsdipol har både negativa och positiva ändar, eller poler, där elektrontätheten är lägre (den positiva polen) och högre (den negativa polen). Skillnaden i elektrondensitet kan uttryckas med hjälp av den grekiska bokstaven delta för att beteckna ’partiell positiv ’och’ partiell negativ ’ laddning på atomerna. ’Dipolpilar’, med ett positivt tecken på svansen, används också för att indikera dipolens negativa (högre elektrondensitet) riktning.
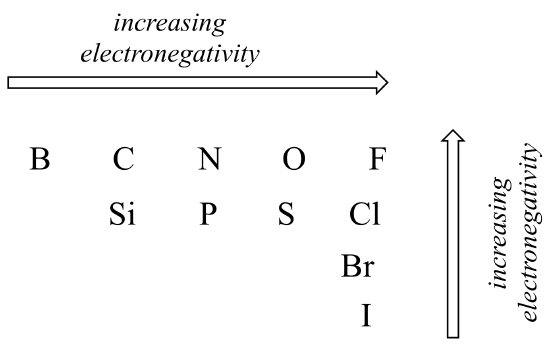
polaritetsgraden i en kovalent bindning beror på skillnaden i elektronegativitet mellan de två atomerna. Elektronegativitet är en periodisk trend: den ökar från vänster till höger över en rad i elementets periodiska tabell och ökar också när vi flyttar upp en kolumn. Därför är syre mer elektronegativt än kväve, vilket i sin tur är mer elektronegativt än kol. Syre är också mer elektronegativt än svavel. Fluor, i det övre högra hörnet av det periodiska bordet, är det mest elektronegativa av elementen. Väte är något mindre elektronegativt än kol.
periodiska trender i elektronegativitet
övning 2.26
använda vad du om atomorbitaler, rationalisera de periodiska trenderna i elektronegativitet. Varför ökar det från vänster till höger och minskar från topp till botten? Det här är en bra fråga att prata igenom med klasskamrater och en instruktör eller handledare.
lösningar på övningar
de flesta molekyler innehåller både polära och icke-polära kovalenta bindningar. Beroende på placeringen av polära bindningar och bindningsgeometri kan molekyler ha en nätpolaritet, kallad ett molekylärt dipolmoment. Vatten, som du förmodligen kommer ihåg, har ett dipolmoment som härrör från de kombinerade dipolerna i dess två syre-vätebindningar. Fluormetan har också ett dipolmoment.
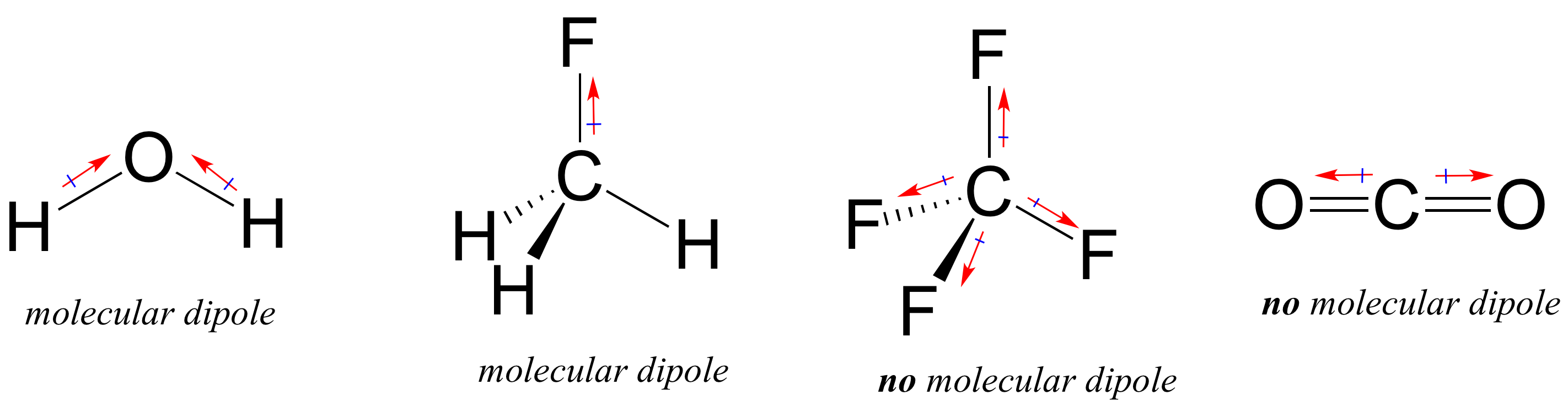
Tetrafluormetan har emellertid fyra polära bindningar som drar Lika in i de fyra hörnen av en tetahedron, vilket betyder att även om det finns fyra bindningsdipoler finns det inget övergripande molekylärt dipolmoment. Koldioxid saknar också ett molekylärt dipolmoment.
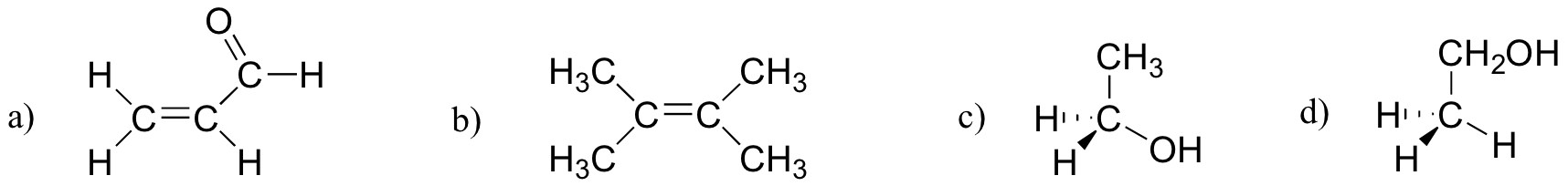
övning 2.27
vilka av molekylerna nedan har molekylära dipolmoment?
lösningar på övningar