fakta, sammanfattning & Definition
- en addukt är en produkt som bildas av en additionsreaktion
- addukter kan endast bildas från reaktanter som har flera bindningar, såsom alkener och karbonylgrupper
- addukter kan bildas genom två typer av additionsreaktion reaktion: elektrofila och nukleofila
- addukter bildas ofta mellan Lewis-syror och Lewis-baser
vad är en addukt?
en addukt är en produkt som bildas i slutet av en additionsreaktion. Detta är en reaktion där två eller flera molekyler reagerar och kombineras för att bilda en större produkt. Denna typ av reaktion kan endast ske mellan kemiska föreningar som har flera bindningar – föreningar som alkener (dubbelbindningar) och alkyner (trippelbindningar). Karbonyl (C=O) och imin (C=N) grupper kan också genomgå additionsreaktioner och därmed bilda addukter.
hur bildas addukter?
som tidigare nämnts bildas addukter genom additionsreaktioner. I denna typ av reaktion bryts dubbelbindningen delvis när en reagerande molekyl attackerar och lägger till. Reaktionen nedan visar en tillsatsreaktion mellan eten och brom.

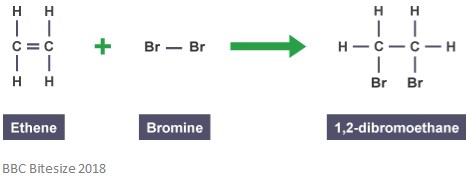
addukten i denna reaktion är 1,2-dibrometan. Detta beror på att det är en distinkt art som innehåller alla atomer av alla komponenter.
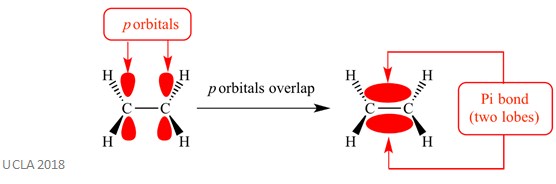
dessa tillsatsreaktioner involverar vanligtvis pi-bindningar (Taiwan). Detta är en komplex typ av bindning där p – orbitalerna på intilliggande atomer överlappar varandra-det är denna överlappning som orsakar pi-bindningen. Detta sker vinkelrätt mot alla sigmabindningar mellan dessa två samma atomer. Denna pi-bindning har också två orbitallober – en ligger ovanför sigma-bindningsplanet och den andra ligger under Sigma-bindningsplanet. Pi-bindningen visas i diagrammet nedan.

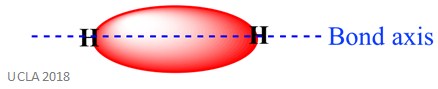
samma reaktion kan också involvera Sigma-bindningar (IC). Detta är en typ av kovalent bindningsform genom överlappning av atomorbitaler längs bindningsaxeln – med andra ord längs linjen som förbinder de två bundna atomerna. Till exempel bildas Sigma – bindningen i en väteatom genom överlappningen av två 1s-orbitaler-en från varje väteatom. Detta visas bättre i bilden nedan-det röda området visade Sigma-bindningen.

det finns två huvudtyper av additionsreaktion: elektrofil tillsats och nukleofil tillsats.
elektrofil tillsats
en elektrofil additionsreaktion är en typ av reaktion där en bindning bryts och två nya bindningar bildas. Som diskuterats tidigare måste reaktanten ha en dubbel – eller trippelbindning-elektrofilen lägger till en pi-bindning i detta fall. Detta är en tillsatsreaktion, och så går ingenting förlorat i processen – alla atomer som finns i reaktantmolekylerna finns också i addukten.

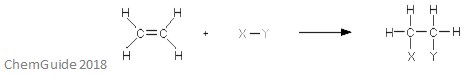
ovanstående bild visar grunden för en elektrofil additionsreaktion. Som du kan se finns alla atomer i reaktanterna i addukten.
nukleofil tillsats
en nukleofil tillsatsreaktion är en typ av reaktion där en dubbelbindning bryts och två enkelbindningar bildas. En elektron-bristfällig (elektrofil) dubbel-eller trippelbindning reagerar med något som är elektronrik (nukleofil). Nukleofilen lägger till en pi-bindning i detta fall. Ett exempel på en nukleofil tillsatsreaktion visas nedan.

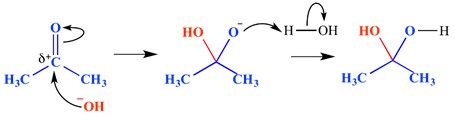
i detta exempel har en hydroxidjon lagt till den delta – positiva änden av karbonylgruppen-detta har bildat en oxyanionisk tetraedrisk mellanliggande molekyl. Slutresultatet är därför tillsatsen av vatten över karbonylgruppens pi-bindning.
Lewis syror och Lewis baser
addukter är ofta kända för att bilda mellan Lewis syror och Lewis baser. Den bildade molekylen kallas en Lewis-syrabasaddukt (eller ett Lewis-syrabas-komplex). Eftersom addukter endast bildas genom additionsreaktioner (det vill säga utan samtidig förlust av en grupp) kan Lewis-syra-och Lewis-basreaktioner inte vara av substitutionsslag.
ett bra exempel på detta är reaktionen mellan THF och BH3, som visas i bilden nedan. Som du kommer att se visas dessa Lewis-syra – Lewis-basaddukter med prickar-dessa representerar elektroner.

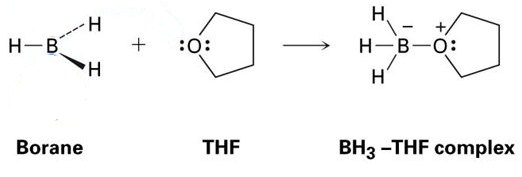
som du kan se är den enda produkt som bildas BH3-THF-komplexet, vilket betyder att det är en addukt.
dessa typer av reaktioner kan också avbildas med pilar – dessa pilar representerar donationen av elektroner från basen till syran. Samma reaktion visas nedan, men med pilar för att indikera elektrondonation.

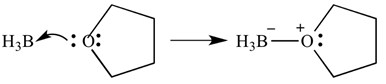
det är viktigt att notera här att dessa pilar har två ”barbs” på den spetsiga änden. Detta indikerar att ett par elektroner har donerats. Om bara en elektron doneras kommer pilen bara att ha ’ en ’ bard på den spetsiga änden.
i detta fall är Lewis-syran Boran och Lewis-basen är THF. Som du kan se har basen donerat ett ensamt par elektroner till syran för att bilda en syre-borbindning.föreningar som inte kan bilda addukter på grund av molekylernas form kallas frustrerade Lewis-par.
Vidare läsning
http://www.chem.ucla.edu/~harding/IGOC/L/lewis_acid_base_adduct.html