Sir,
skivepitelcancer (SCC) i huden är frekventa maligna hudtumörer, med en förekomst av 30 per 100 000 invånare per år i Västeuropa. I soligare klimat är de ännu vanligare. SCC utvecklas vanligtvis från aktiniska keratoser. Förutom solljus inkluderar andra predisponeringsfaktorer joniserande strålning, kronisk inflammation med ärrbildning, virusinfektioner och immunsuppression. Organtransplantationspatienter har en markant ökad risk, kanske 200 gånger, att utveckla SCC på grund av deras immunsuppressiva terapi (1). Detsamma gäller för patienter med immunbrist på grund av andra faktorer, till exempel de med HIV-infektion (1, 2).
fallrapport
en 50-årig man presenterade en stor tumör på hans vänstra kind, som hade utvecklats under de senaste 3 månaderna. Tumören hade en upphöjd kant och ett centralt utstansat sår. Han hade rest i Tunisien 6 månader tidigare med mycket sol exponering. Även om han hade Fitzpatrick skin type II, hade han aldrig utövat solskydd. Klinisk undersökning avslöjade inte ytterligare tecken på aktinisk skada; specifikt hade han inga aktiniska keratoser. Sedan hans vistelse i Tunisien hade patienten också en kronisk torr hosta. Hans livmoderhals lymfkörtlar var normala vid palpation och med ultraljudsundersökning. Magnetisk resonanstomografi visade ingen infiltration av intilliggande mjukvävnadsstrukturer. På grund av tumörens snabba tillväxt och dess makroskopiska utseende misstänkte vi ett keratoakantom. Histologisk undersökning avslöjade en väl differentierad men ulcererad SCC. Flödescytometrisk analys av perifera T-celler avslöjade en obalans, med endast 5 CD4+ / CD3 + – celler och 226 CD8+/CD3+ – celler (förhållande 0,02), vilket indikerar immunbrist och kanske förklarar tumörens snabba tillväxt. Trots omfattande rådgivning om en potentiellt underliggande immunsuppressiv sjukdom avvisade patienten ytterligare HIV-diagnostiska procedurer, liksom ytterligare studier för att klargöra hosta (misstänkt Pneumocystis jiroveci lunginflammation) och utesluta metastaser. Han avvisade också re-excision med bredare marginaler och lämnade sjukhuset mot medicinsk rådgivning.

Fig. 1. Vänster kind av en 50-årig man med en stor tumör. (a) Dorsal och (b) lateral aspekt.
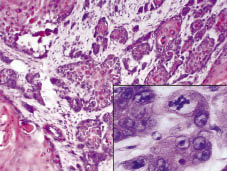
Fig. 2. Histologisk undersökning avslöjade en djup infiltrerande tumör som förstörde de lesionella anatomiska strukturerna. Infoga: tumören består av polymorfa keratinocyter med flera mitoser (H&E 200, med digital förstoring).
diskussion
Keratoacanthoma (KA) beskrevs först 1889 av Jonathan Hutchinson som krateriform sår i ansiktet. Det förekommer oftast som en snabbt växande hudtumör på solexponerade områden (3). Män drabbas ungefär 3 gånger oftare än kvinnor. Den justerade åldersfördelningen visar att den är vanligast i medelåldern och inte ökar förekomsten hos äldre (till skillnad från basalcellkarcinom och SCC) (4). Medan SCC utvecklas från ytepitel, härrör KAs från hårfollikelväggen precis ovanför där sebaceous kanalen kommer in. De är en distinkt enhet med specifika kliniska och histologiska egenskaper (5). Tendensen till spontan regression och den omfattande graden av keratinisering är de mest slående funktionerna, tillsammans med tumörens typiska symmetriska arkitektur (6).
den exakta nosologin och klassificeringen av KA är en fråga om debatt. Vissa författare betraktar KA som en godartad kutan tumör som är prototypen av de ”pseudomalignanta” tumörerna i huden, medan andra hävdar att det är malign neoplasma – en märklig variant av SCC – och därför bör behandlas som SCC (7-9). De diagnostiska svårigheterna är särskilt sanna för de destruktiva, ihållande varianterna av KA, såsom jätte KA eller lemlästande KA. Kliniskt skiljer sig KA från SCC genom sin historia av snabb tillväxt och dess vulkanliknande form. Men i det fall som beskrivs här visade en stor SCC också mycket snabb tillväxt, möjligen på grund av HIV-infektion. Ibland måste lesioner som betraktas som KAs omklassificeras som SCC på grundval av deras efterföljande kliniska förlopp. Förutom en felaktig diagnos är andra förklaringar kombinationen av KA och SCC samt omvandlingen av KA till SCC. Dessutom kan vissa KAs vara väl differentierade varianter av SCC, som föreslagits av Ackerman (10-12).
på grund av svårigheterna att skilja mellan KA och SCC är valet av behandling för alla typer av KAs fortfarande kirurgisk excision med histopatologisk verifiering av diagnosen (8-10). Om kirurgi är omöjligt kan joniserande strålning övervägas. Flera andra terapeutiska alternativ, såsom topisk 5-fluorouracil, intralesionala injektioner av interferon-alfa, metotrexat eller bleomycin och systemiskt administrerade retinoider, har rapporterats vara effektiva i enskilda fall, men det finns inga kontrollerade kliniska prövningar som visar effektiviteten hos dessa behandlingar (1, 4, 5).
vissa SCC kan växa snabbt och efterlikna en KA, som i det fall som beskrivs här. Anledningen till den snabba tillväxten av KAs är oklar; flera hypoteser har erbjudits, inklusive immunsuppression och exponering för överdriven solljus. KAs, särskilt de som inte tydligt kan särskiljas från SCC, bör behandlas med bred kirurgisk excision, eftersom de kan ha en ogynnsam prognos med tidig utveckling av metastaser.
1. Sterry W, Stockfleth E. Maligne epitheliale tumör. I: Braun-Falco O, Plewig G, Wolff HH, Burgdorf WH, Landthaler M, redaktörer. Dermatologi och venerologi. 5: e edn. Heidelberg: Springer, 2005: s. 1267-1276.
2. Nguyen P, Vin-Christian K, Ming ME, Berger T. aggressiva skivepitelcancer hos personer infekterade med humant immunbristvirus. Arch Dermatol 2002; 138: 758–763.
3. Rinker MH, Fenske NA, Scalf LA, glas LF. Histologiska varianter av skivepitelcancer i huden. Cancer Kontroll 2001; 8: 354-363.
4. Mac Kie RM, Quinn AG. Icke melanom hudcancer och epidermala hudtumörer. I: Burns T, Breathnack S, Cox N, Griffiths C, redaktörer. Rooks lärobok för dermatologi. 7: e edn. Massachusetts: Blackwell Science, 2004: s. 43-46.
5. Kurschat P, Hess S, Hunzelmann N, Scharffetter-Kochanek K. Keratoacanthoma centrifugum marginatum åtföljd av omfattande granulomatös främmande kroppsreaktion. Dermatol Nätet J 2005; 11: 16.
6. Bayer-Garner IB, Ivan D, Schwartz MR, Tschen JA. Immunopatologin för regression i godartad lichenoid keratos, keratoacanthom och halo nevus. Clin Med Res 2004; 2: 89-97.
7. Cribier B, Asch P, Grosshans E. differentiering av skivepitelcancer från keratoacanthom med histopatologiska kriterier. Är det möjligt? En studie av 296 fall. Dermatologi 1999; 199: 208-212.
8. Beham a, Regauer S, Soyer HP, Beham-Schmid C. Keratoacanthoma: en kliniskt distinkt variant av väl differentierat skivepitelcancer. Adv Anat Pathol 199; 5: 269-280.
9. Warner DM, blommor F, Ramos-Caro FA. Ensam keratoacanthom( skivepitelcancer): kirurgisk hantering. Int J Dermatol 1995; 34: 17-19.
10. Hodak E, Jones RE, Ackerman AB. Solitärt keratoacanthom är ett skivepitelcancer: tre exempel med metastaser. Am J Dermatopathol 1993; 15: 332-342.
11. Sanchez YE, Simon P, Requena L, Ambrojo P, de Eusebio E. ensam keratoacanthoma: en självläkande spridning som ofta blir malign. Am J Dermatopathol 2000; 22: 305-310.
12. Lawrence N, Reed RJ. Aktinisk keratoakantom. Spekulationer om arten av lesionen och rollen av cellulär immunitet i dess utveckling. Am J Dermatopathol 1990; 12: 517-533.