Generic Name: epinastine hydrochloride
Dosage Form: ophthalmic solution
Medically reviewed by Drugs.com. Last updated on June 1, 2020.
- Overview
- Side Effects
- Dosage
- Professional
- Pregnancy
- More
Indications and Usage for Epinastine HCl Ophthalmic Solution
Epinastine HCl Ophthalmic Solution 0.05% är indicerat för förebyggande av klåda i samband med allergisk konjunktivit.
Epinastin HCl oftalmisk lösning dosering och administrering
den rekommenderade dosen är en droppe i varje öga två gånger om dagen.
behandlingen ska fortsätta under hela exponeringsperioden (dvs. tills pollensäsongen är över eller tills exponeringen för det kränkande allergenet avslutas), även när symtomen saknas.
doseringsformer och styrkor
lösning innehållande 0.5 mg/mL epinastin HCl
kontraindikationer
ingen
varningar och försiktighet
kontaminering av spets och lösning
patienter ska instrueras att undvika att spetsen på doseringsbehållaren kommer i kontakt med ögat, omgivande strukturer, fingrar eller någon annan yta för att undvika kontaminering av lösningen av vanliga bakterier som är kända för att orsaka okulära infektioner. Allvarlig skada på ögat och efterföljande synförlust kan bero på att använda förorenade lösningar.
flaskan ska hållas tätt stängd när den inte används.
användning med kontaktlinser
patienter ska rådas att inte bära kontaktlinser om ögat är rött. Epinastin HCl oftalmisk lösning 0, 05% ska inte användas för att behandla kontaktlinsrelaterad irritation.
konserveringsmedlet i Epinastin HCl oftalmisk lösning 0,05%, bensalkoniumklorid, kan absorberas av mjuka kontaktlinser. Kontaktlinser bör avlägsnas före instillation av Epinastin HCl oftalmisk lösning 0, 05% och kan sättas in igen efter 10 minuter efter administrering.
endast topisk oftalmisk användning
Epinastin HCl oftalmisk lösning 0.05% är endast för topisk oftalmisk användning och inte för injektion eller oral användning.
biverkningar
kliniska studier upplever
eftersom kliniska studier utförs under mycket varierande förhållanden kan biverkningar som observerats i de kliniska studierna av ett läkemedel inte direkt jämföras med frekvensen i de kliniska studierna av ett annat läkemedel och kanske inte återspeglar de frekvenser som observerats i praktiken.
de vanligaste rapporterade okulära biverkningarna som inträffade hos cirka 1-10% av patienterna var brännande känsla i ögat, follikulos, hyperemi och klåda.
de vanligast rapporterade icke-okulära biverkningarna var infektion (förkylningssymtom och övre luftvägsinfektioner), som sågs hos cirka 10% av patienterna, och huvudvärk, rinit, sinusit, ökad hosta och faryngit, som sågs hos cirka 1 – 3% av patienterna.
några av dessa reaktioner liknade den underliggande sjukdomen som studerades.
erfarenhet efter marknadsföring
följande reaktioner har identifierats vid användning efter marknadsföring av Epinastin HCl oftalmisk lösning 0, 05% i klinisk praxis. Eftersom de rapporteras frivilligt från en population av okänd storlek, uppskattningar av frekvens kan inte göras. Reaktionerna, som har valts för inkludering på grund av antingen deras allvar, rapporteringsfrekvens, möjlig orsakssamband med Epinastin HCl oftalmisk lösning 0, 05%, eller en kombination av dessa faktorer, inkluderar: ökad lakrimation.
användning i specifika populationer
graviditet
teratogena effekter
graviditetskategori C
i en embryofetal utvecklingsstudie på dräktiga råttor observerades maternell toxicitet utan embryofetala effekter vid en oral dos som var ungefär 150 000 gånger den maximala rekommenderade okulära humana dosen (MROHD) på 0,0014 mg/kg/dag på mg / kg-basis. Totala resorptioner och abort observerades i en embryofetal studie på dräktiga kaniner vid en oral dos som var cirka 55 000 gånger MROHD. I båda studierna noterades inga läkemedelsinducerade teratogena effekter.
Epinastin minskade valpens kroppsvikt efter en oral dos till dräktiga råttor som var ungefär 90 000 gånger MROHD.
det finns dock inga adekvata och välkontrollerade studier på gravida kvinnor. Eftersom djurreproduktionsstudier inte alltid är prediktiva för humant svar, ska Epinastin HCl oftalmisk lösning 0, 05% endast användas under graviditet om den potentiella nyttan motiverar den potentiella risken för fostret.
ammande mödrar
en studie på lakterande råttor avslöjade utsöndring av epinastin i bröstmjölken. Det är inte känt om detta läkemedel utsöndras i bröstmjölk. Eftersom många läkemedel utsöndras i bröstmjölk, bör försiktighet iakttas när Epinastin HCl oftalmisk lösning 0,05% administreras till en ammande kvinna.
pediatrisk användning
säkerhet och effektivitet hos barn under 2 år har inte fastställts.
geriatrisk användning
inga övergripande skillnader i säkerhet eller effekt har observerats mellan äldre och yngre patienter.
Epinastin HCl oftalmisk lösning beskrivning
Epinastin HCl oftalmisk lösning 0.05% is a clear, colorless, sterile isotonic solution containing epinastine HCl, an antihistamine and an inhibitor of histamine release from the mast cell for topical administration to the eyes.
Epinastine HCl is represented by the following structural formula:
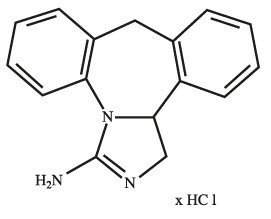
C16H15N3HCl Mol. Wt. 285.78
Chemical Name:
3-Amino-9,13b-dihydro-1H-dibenzimidazoazepine hydrochloride
Each mL contains: Active: Epinastine HCl 0.05% (0.5 mg/mL) equivalent to epinastine 0.044% (0.44 mg/mL); Preservative: Benzalkonium chloride 0.01%; Inactives: Edetat dinatrium, dihydrat; renat vatten; natriumklorid; natriumfosfat, monobasiskt, vattenfritt; och natriumhydroxid och/eller saltsyra (för att justera pH).
Epinastin HCl oftalmisk lösning 0, 05% har ett pH på ungefär 7 och ett osmolalitetsområde på 250 till 310 mOsm/kg.
Epinastin HCl oftalmisk lösning-klinisk farmakologi
verkningsmekanism
Epinastin är en topiskt aktiv, direkt H1-receptorantagonist och en hämmare av frisättningen av histamin från mastcellen. Epinastin är selektiv för histamin H1-receptorn och har affinitet för histamin H2-receptorn. Epinastin har också affinitet för receptorerna av typ 1, 2 och 5-HT2.
farmakokinetik
fjorton patienter, med allergisk konjunktivit, fick en droppe Epinastin HCl oftalmisk lösning 0, 05% i varje öga två gånger dagligen i 7 dagar. På dag 7 uppnåddes genomsnittliga maximala plasmakoncentrationer av epinastin på 0,04 0,014 ng / ml efter cirka två timmar, vilket indikerar låg systemisk exponering. Även om dessa koncentrationer representerade en ökning jämfört med de som sågs efter en engångsdos, var dag 1-och dag 7-arean Under kurvan (AUC) – värdena oförändrade vilket indikerar att det inte finns någon ökning av systemisk absorption vid multipel dosering. Epinastin är 64% bundet till plasmaproteiner. Det totala systemiska clearance är cirka 56 L/timme och den terminala halveringstiden i plasma är cirka 12 timmar. Epinastin utsöndras huvudsakligen oförändrat. Cirka 55% av en intravenös dos återvinns oförändrad i urinen med cirka 30% i avföring. Mindre än 10% metaboliseras. Renal eliminering sker huvudsakligen via aktiv tubulär sekretion.
icke-klinisk toxikologi
karcinogenes, mutagenes, nedsatt fertilitet
i karcinogenicitetsstudier i kosten på möss respektive råttor var epinastin inte karcinogent vid doser upp till 40 mg / kg .
Epinastin i nyligen syntetiserade satser var negativt för mutagenicitet i Ames / Salmonella-analysen och in vitro kromosomavvikelseanalys med användning av humana lymfocyter. Positiva resultat sågs med tidiga partier av epinastin i två in vitro-kromosomavvikelsestudier utförda på 1980-talet med humana perifera lymfocyter respektive med V79-celler. Epinastin var negativt i klastogenicitetsstudierna in vivo, inklusive musmikrokärnanalys och kromosomavvikelseanalys i kinesiska hamstrar. Epinastin var också negativt i celltransformationsanalysen med syriska hamsterembryoceller, V79/HGPRT-mutationsanalys av däggdjursceller och in vivo/in vitro oplanerad DNA-syntesanalys med användning av primära hepatocyter från råtta.
Epinastin hade ingen effekt på fertiliteten hos hanråttor. Minskad fertilitet hos honråttor observerades vid en oral dos upp till cirka 90 000 gånger MROHD.
kliniska studier
Epinastin HCl 0,05% har visat sig vara signifikant överlägsen vehikel för att förbättra okulär klåda hos patienter med allergisk konjunktivit i kliniska studier med två olika modeller: (1) conjunctival antigen challenge (CAC) där patienter doserades och sedan fick antigen instillerat i den sämre konjunktival fornix; och (2) miljöfältstudier där patienter doserades och utvärderades under allergisäsongen i deras naturliga livsmiljö. Resultaten visade en snabb insättande effekt för epinastin HCl 0,05% inom 3 till 5 minuter efter konjunktival antigenutmaning. Effektens varaktighet visade sig vara 8 timmar, vilket gjorde en behandling två gånger dagligen lämplig. Denna doseringsregim visade sig vara säker och effektiv i upp till 8 veckor, utan tecken på takyfylax.
hur levereras / förvaras och hanteras
Epinastin HCl oftalmisk lösning 0.05% levereras sterilt i ogenomskinliga vita LDPE – plastflaskor med droppspetsar och vita polypropylenlock (PP) enligt följande:
| 5 mL i 10 mL flaska | NDC 51991-836-75 |
Lagring: förvara vid 20 – 25-25-C (68-77-f) . Förvara flaskan väl tillsluten och utom räckhåll för barn.
Patientrådgivningsinformation
Droppspetsens sterilitet
patienter bör rådas att inte vidröra droppspetsen på någon yta, eftersom detta kan förorena innehållet (se varningar och försiktighetsåtgärder, 5.1).
samtidig användning av kontaktlinser
patienter ska rådas att inte bära kontaktlinser om deras ögon är röda. Patienter bör informeras om att Epinastin HCl oftalmisk lösning 0, 05% inte ska användas för att behandla kontaktlinsrelaterad irritation. Patienter bör också rådas att ta bort kontaktlinser före instillation av Epinastin HCl oftalmisk lösning 0, 05%.
konserveringsmedlet i Epinastin HCl oftalmisk lösning 0,05%, bensalkoniumklorid, kan absorberas av mjuka kontaktlinser. Linser kan sättas in igen efter 10 minuter efter administrering av Epinastin HCl oftalmisk lösning 0,05%
endast topisk oftalmisk användning
endast för topisk oftalmisk administrering.
endast Rx
distribueras av:
Breckenridge Pharmaceutical, Inc.
Berlin, CT 06037
Tillverkad av:
Primafarma, Inc.
San Diego, CA 92121
Rev: 04/2020
2323 04/20
PRINCIPAL DISPLAY PANEL – 5 mL Bottle Carton
NDC 51991-836-75
Epinastine HCl
Ophthalmic
Solution,
0.05%
FOR USE IN THE
EYES ONLY
sterile
Rx Only
5 mL sterile
breckenridge
A Towa
Company

| EPINASTINE HYDROCHLORIDE epinastine hydrochloride solution/ drops |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Labeler – Breckenridge Pharmaceutical, Inc. (150554335)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| PrimaPharma, Inc. | 079699106 | MANUFACTURE(51991-836) | |
mer om epinastin oftalmisk
- biverkningar
- under graviditet eller amning
- doseringsinformation
- prissättning& kuponger
- på engelska
- 3 recensioner
- läkemedelsklass: Oftalmiska antihistaminer och avsvällande medel
konsumentresurser
- patientinformation
- Epinastin oftalmisk (avancerad läsning)
professionella resurser
- förskrivningsinformation
- Epinastin (professionell patientrådgivning)
andra märken Elestat
relaterade behandlingsguider
- konjunktivit, allergisk
Medicinsk ansvarsfriskrivning