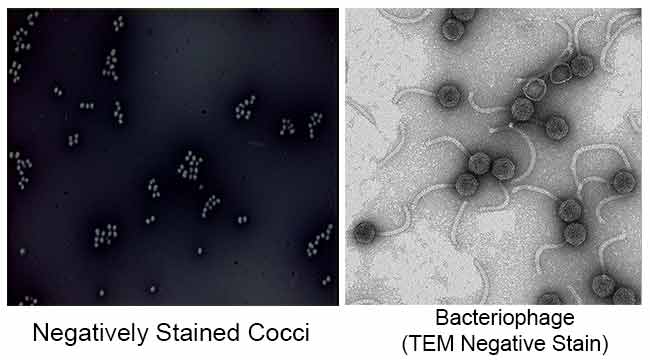
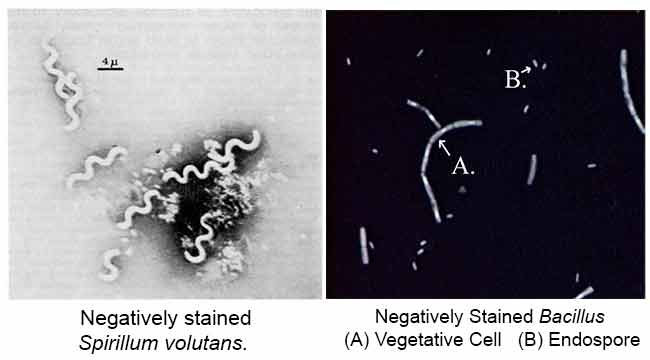
huvudsyftet med negativ färgning är att studera den morfologiska formen, storleken och arrangemanget av bakteriecellerna som är svåra att fläcka. till exempel: Spirilla. Det kan också användas för att fläcka celler som är för känsliga för att vara värmefixerade.
det används också för att förbereda biologiska prover för elektronmikroskopi. Det används för att se virus, bakterier, bakteriell flagella, biologiska membranstrukturer och proteiner eller proteinaggregat, som alla har en låg elektronspridningskraft. Det används också för studier och identifiering av vattenhaltiga lipidaggregat som lamellära liposomer (le), inverterade sfäriska miceller (M) och inverterade hexagonala HII cylindriska (H) faser genom negativ färgningstransmissionselektronmikroskopi.
principen om negativ färgning
negativ färgning kräver ett surt färgämne som Indien bläck eller Nigrosin.
Indien bläck eller Nigrosin är en sur fläck. Detta innebär att fläcken lätt ger upp en vätejon (proton) och färgämnets kromofor blir negativt laddad. Eftersom ytan på de flesta bakterieceller är negativt laddad, stöter cellytan bort fläcken. Glaset på bilden kommer att fläcka, men bakteriecellerna kommer inte. Bakterierna kommer att dyka upp som tydliga fläckar mot en mörk bakgrund.
reagenser av negativ färgning
Indien bläck
Nigrosin
Nigrosin 100 gm/L, Formalin 5 ml/l i vatten
förfarande för negativ färgning
1. Placera en mycket liten droppe (mer än en slinga full, mindre än en fritt fallande droppe från droppen) av nigrosin nära ena änden av en väl rengjord och flammad glid.
2. Ta bort en liten mängd av kulturen från snedställningen med en ympningsslinga och sprida den i fläckdroppen utan att sprida droppen.

3. Använd en annan ren bild för att sprida fläcken som innehåller organismen med följande teknik.

4. Vila ena änden av den rena bilden i mitten av bilden med fläcken. Luta den rena bilden mot droppen och bilda en spetsig vinkel och dra den mot droppen tills den vidrör droppen och får den att spridas längs kanten på spridarglaset. Bibehålla en liten spetsig vinkel mellan glidbanorna, tryck spridarglaset mot den rena änden av gliden som färgas och dra droppen bakom spridarglaset och producera ett brett, jämnt, tunt smet.
 |
 |
5. Låt smeten torka utan uppvärmning.

6. Fokusera ett tunt område under oljedämpning och observera de ofärgade cellerna omgivna av den grå fläcken.
förfarande för att visa i transmissionselektronmikroskop (TEM)
- Håll en belagd grid flim sida upp i ett par självklämmande pincett.
- gör en 1: 1-blandning av prov och negativ fläck (t.ex. 2% uranylacetat eller 2% natrium-eller kaliumfosfotungstate, pH 7,4). Lägg till 5 occyl till gallret. Mindre partiklar adsorberar till gallerytan snabbare än större partiklar.alternativt kan provet blandat med fixativ läggas till gallret före efterföljande negativ färgning.
- inkubera i 30-90 sekunder och ta sedan bort överflödig vätska med den trasiga kanten på ett filterpapper.
- lufttorka och undersök i TEM.
resultat av negativ färgning