identifiera en molekyls mest sura H
ett metodiskt tillvägagångssätt fungerar bäst. Enkelt uttryckt måste du skanna molekylen för sura funktionella grupper och sedan rangordna reaktiviteten hos dessa grupper. Den mest sura funktionella gruppen håller vanligtvis den sura H i hela molekylen.
” Scan and rank ” låter enkelt, men det döljer flera svårigheter som utarbetas nedan.
skanna en molekyl för kända sura funktionella grupper
sura protoner är vanligtvis bundna till O eller N. Därför är det första steget att leta efter alla OH-och NH-obligationer.
men när du hittar OH-och NH-bindningar måste du bestämma om dessa bundna atomer ska klumpas i en funktionell grupp med angränsande atomer.
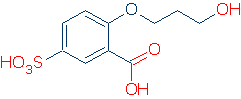
den enda praktiska metoden för att identifiera en funktionell grupp är att redan känna till några. Om du till exempel vet att ROH, RCO2H och RSO3H är vanliga sura funktionella grupper, har du inga problem med att hitta sura grupper i följande molekyl (de korrekta grupperna är markerade i rött).
rang OH och nh surhet separat
PKA-värdena för vanliga OH-och NH-syror spänner över breda intervall och deras intervall överlappar varandra. Rankning fortsätter snabbare om du rankar OH-och NH-syrorna separat och jämför sedan de bästa kandidaterna i varje kategori.
den mest praktiska metoden för att rangordna sura grupper är att redan känna till deras karakteristiska pKa-värden. Om du känner till dessa värden för alla sura grupper i din molekyl, innehåller gruppen med den lägsta pKa den mest sura H. Case closed.
om du inte kommer ihåg pKa-värden för alla sura grupper kan några allmänna principer vägleda dig.
#1 betydelse – positivt laddade syror är starkare än neutrala syror. Negativt laddade syror är sällan sura. Om du jämför PKA-värden för vanliga OH-syror ser du att ROH2 + – syror (som inkluderar H3O+ och R2OH+) är betydligt starkare än neutrala syror, såsom RCO2H, PhOH och ROH. De enda neutrala syrorna som är starkare än ROH2+ är H2SO4 och vissa andra RSO3H.
den formella laddningsregeln gäller ännu starkare för nh-syror. Skillnaden i pKa mellan H3O+ och H2O är 18 enheter, medan skillnaden i pKa mellan NH4+ och NH3 är en gigantisk 26 enheter.
#2 betydelse – leta efter aktiverande grupper, inklusive RSO2, RC=o och pH.följande diagram visar hur varje grupp av atomer aktiverar en OH-syra (pKa-värden sträcker sig från 16 till -2):
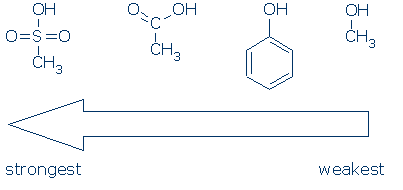
CH3 anses vara en åskådargrupp varhelst den förekommer i dessa molekyler. Det är icke-polärt och utövar ingen signifikant fältinduktiv effekt, och det är oförmöget att dela upp laddningen. Följaktligen är det möjligt att ersätta CH3 med andra åskådargrupper (till exempel H och andra R) utan att påverka reaktiviteten mycket.
ytterligare två punkter bör göras om aktiverande grupper.
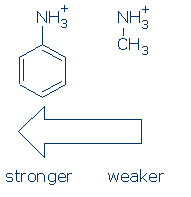
För det första har grupperna en liknande effekt på NH-syror (och aktiveringssekvensen är densamma: RSO2> RC=o> Ph). När det händer behöver du bara lära dig effekten av Ph på NH+ för den här kursen:
För det andra måste de aktiverande grupperna bindas direkt till OH (eller NH) – gruppen för att aktivera den. Följande föreningar har liknande pKa-värden eftersom de aktiverande grupperna inte är bundna direkt till OH: CH3C(=O)CH2OH, PhCH2OH och CH3CH2OH.
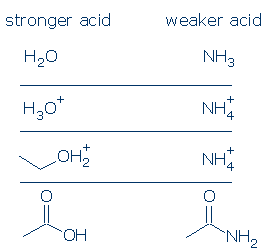
#3 betydelse – allting är lika, en OH-syra är surare än en NH-syra. Denna princip kan vara mycket användbar om den används korrekt. Min oro är att du förstår vad som menas med ” allt är lika.”Det betyder att O och N måste ha samma formella laddning (punkt #1) och måste vara bundna till samma aktiveringsgrupp (punkt #2). Skillnader i åskådargrupper spelar dock ingen roll.
några giltiga jämförelser inkluderar:
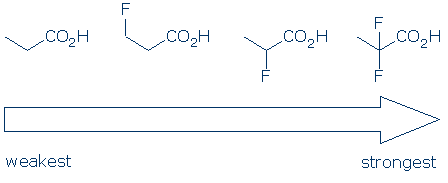
#4 betydelse – inom en funktionell gruppkategori, använd substituenta effekter för att jämföra syror. Elektronegativa substituenter förbättrar vanligtvis surheten hos en funktionell grupp genom en kombination av fält-och induktiva effekter. Dessa effekter förbättras när 1) substituenten ligger närmare den sura gruppen och 2) Det finns flera substituenter. Med tanke på dessa principer förväntar vi oss att surheten hos dessa karboxylsyror följer denna trend: