Más ácido Identifica el H
más ácido de una molécula Un enfoque metódico funciona mejor. En pocas palabras, debe escanear la molécula en busca de grupos funcionales ácidos y luego clasificar la reactividad de estos grupos. El grupo funcional más ácido suele contener la H más ácida de toda la molécula.
«Escanear y clasificar» suena simple, pero oculta varias dificultades que se detallan a continuación.
Escanee una molécula en busca de grupos funcionales ácidos conocidos
Los protones ácidos generalmente se unen a O o N. Por lo tanto, el primer paso es buscar todos los enlaces OH y NH.
Sin embargo, a medida que localice los enlaces OH y NH, tendrá que decidir si estos átomos enlazados deben agruparse en un grupo funcional con átomos vecinos.
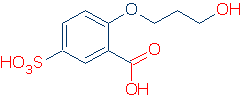
El ÚNICO método conveniente para identificar un grupo funcional es conocer ya algunos. Por ejemplo, si sabes que ROH, RCO2H y RSO3H son grupos funcionales ácidos comunes, no tendrás problemas para encontrar grupos ácidos en la siguiente molécula (los grupos correctos están marcados en rojo).
Clasifica la acidez de OH y NH por separado
Los valores de pKa de los ácidos de OH y NH comunes abarcan amplios rangos y sus rangos se superponen. La clasificación avanza más rápidamente si clasifica los ácidos OH y NH por separado, y luego compara a los mejores candidatos en cada categoría.
El método más conveniente para clasificar los grupos ácidos es conocer ya sus valores característicos de pKa. Si conoce estos valores para todos los grupos ácidos de su molécula, entonces el grupo con el pKa más bajo contiene el caso H más ácido cerrado.
Si no recuerda los valores de pKa para todos los grupos ácidos, algunos principios generales pueden guiarlo.
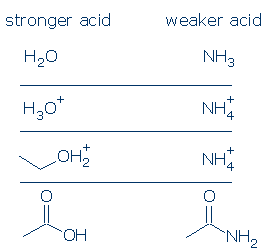
#1 Importancia-los ácidos con carga positiva son más fuertes que los ácidos neutros. Los ácidos cargados negativamente rara vez son ácidos. Si compara los valores de pKa de ácidos OH comunes, verá que los ácidos ROH2+ (que incluyen H3O+ y R2OH+) son considerablemente más fuertes que los ácidos neutros, como RCO2H, PhOH y ROH. Los únicos ácidos neutros que son más fuertes que el ROH2+ son el H2SO4 y algunos otros RSO3H.
La regla de carga formal se aplica aún más a los ácidos NH. La diferencia en pKa entre H3O+ y H2O es de 18 unidades, mientras que la diferencia en pKa entre NH4+ y NH3 es de 26 unidades gigantescas.
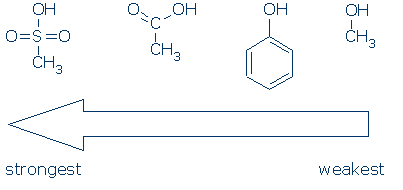
# 2 Importancia-busque grupos activadores, incluidos RSO2, RC = O y Ph. La siguiente tabla muestra cómo cada grupo de átomos activa un ácido OH (los valores de pKa varían de 16 a -2):
CH3 se considera un grupo de espectadores dondequiera que aparezca en estas moléculas. No es polar y no ejerce un efecto inductivo de campo significativo, y es incapaz de deslocalizar la carga. En consecuencia, es posible reemplazar CH3 con otros grupos de espectadores (por ejemplo, H y otros R) sin afectar mucho la reactividad.
Deben hacerse dos observaciones adicionales en relación con los grupos de activación.
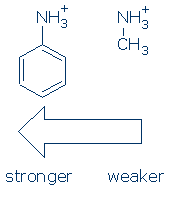
En primer lugar, los grupos ejercen un efecto similar sobre los ácidos NH (y la secuencia de activación es la misma: RSO2 > RC=O > Ph). Como sucede, solo necesitas aprender el efecto del Ph en NH+ para este curso:
En segundo lugar, los grupos activadores deben vincularse directamente al grupo OH (o NH) para activarlo. Los siguientes compuestos tienen valores de pKa similares porque los grupos activadores no están unidos directamente al OH: CH3C(=O)CH2OH, PhCH2OH y CH3CH2OH.
# 3 Importancia-siendo todas las cosas iguales, un ácido OH es más ácido que un ácido NH. Este principio puede ser muy útil si se usa correctamente. Mi preocupación es que entiendas lo que significa » todas las cosas son iguales.»Esto significa que O y N deben tener el mismo cargo formal (artículo #1) y deben estar unidos al mismo grupo activador (artículo #2). Sin embargo, las diferencias en los grupos de espectadores no importan.
Algunas comparaciones válidas incluyen:
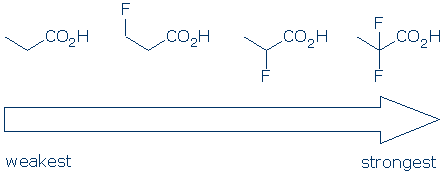
#4 Importancia: dentro de una categoría de grupo funcional, use efectos sustituyentes para comparar ácidos. Los sustituyentes electronegativos generalmente mejoran la acidez de un grupo funcional a través de una combinación de efectos inductivos y de campo. Estos efectos aumentan cuando 1) el sustituyente se encuentra más cerca del grupo ácido, y 2) hay múltiples sustituyentes. Dados estos principios, esperamos que la acidez de estos ácidos carboxílicos de seguir esta tendencia: