Dipolos
Para comprender la naturaleza de las interacciones no covalentes, primero debemos volver a los enlaces covalentes y profundizar en el tema de los dipolos. Muchos de los enlaces covalentes que hemos visto, entre dos carbonos, por ejemplo, o entre un carbono y un hidrógeno, implican el intercambio aproximadamente igual de electrones entre los dos átomos en el enlace. En estos ejemplos, los dos átomos tienen aproximadamente la misma electronegatividad. Recuerde de su curso de química general que la electronegatividad se refiere al «poder de un átomo en una molécula para atraer electrones hacia sí mismo» (esta es la definición ofrecida por Linus Pauling, el eminente químico estadounidense del siglo XX que fue el principal responsable de desarrollar muchos de los conceptos de unión que hemos estado aprendiendo).
Sin embargo, muy a menudo en química orgánica tratamos con enlaces covalentes entre dos átomos con electronegatividades diferentes, y en estos casos el intercambio de electrones no es igual: el núcleo más electronegativo tira de los dos electrones más cerca. En el enlace carbono-oxígeno de un alcohol, por ejemplo, los dos electrones en el enlace sigma se mantienen más cerca del oxígeno que del carbono, porque el oxígeno es significativamente más electronegativo que el carbono. Lo mismo es cierto para el enlace oxígeno-hidrógeno, ya que el hidrógeno es ligeramente menos electronegativo que el carbono, y mucho menos electronegativo que el oxígeno.
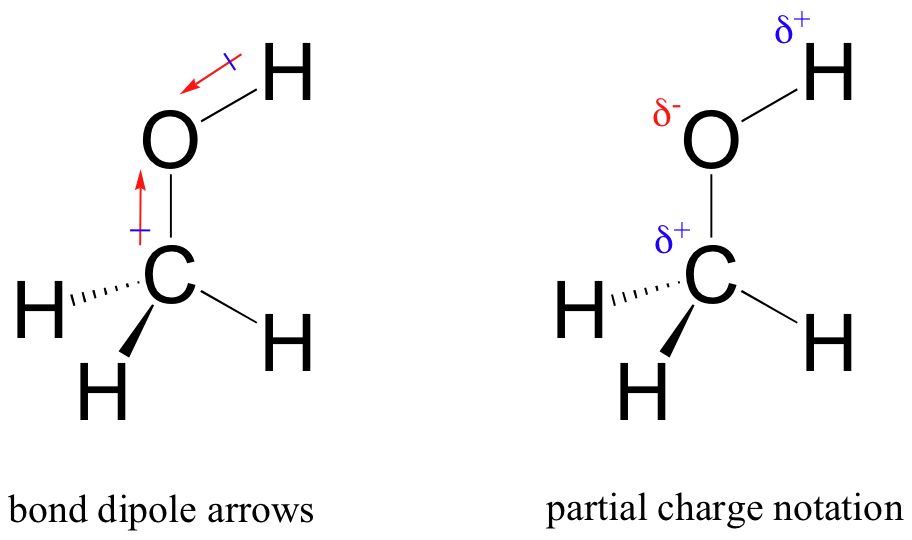
El resultado de este intercambio desigual es lo que llamamos un bono dipolo, que existe en un enlace covalente polar. Un dipolo de enlace tiene extremos negativos y positivos, o polos, donde la densidad electrónica es menor (el polo positivo) y mayor (el polo negativo). La diferencia en la densidad electrónica se puede expresar usando la letra griega delta para denotar carga’ positiva parcial ‘y’ negativa parcial ‘ en los átomos. Las ‘flechas dipolares’, con un signo positivo en la cola, también se utilizan para indicar la dirección negativa (mayor densidad electrónica) del dipolo.
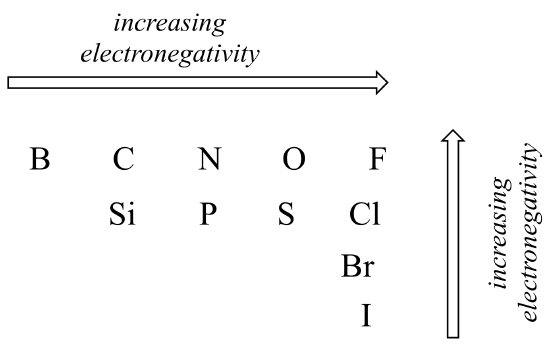
El grado de polaridad en un enlace covalente depende de la diferencia de electronegatividad entre los dos átomos. La electronegatividad es una tendencia periódica: aumenta yendo de izquierda a derecha a través de una fila de la tabla periódica de los elementos, y también aumenta a medida que subimos una columna. Por lo tanto, el oxígeno es más electronegativo que el nitrógeno, que a su vez es más electronegativo que el carbono. El oxígeno también es más electronegativo que el azufre. El flúor, en la esquina superior derecha de la tabla periódica, es el más electronegativo de los elementos. El hidrógeno es ligeramente menos electronegativo que el carbono.
Tendencias periódicas en electronegatividad
Ejercicio 2.26
Utilizando lo que usted sabe sobre orbitales atómicos, racionalice las tendencias periódicas en electronegatividad. ¿Por qué aumenta de izquierda a derecha y disminuye de arriba a abajo? Esta es una buena pregunta para hablar con compañeros de clase y un instructor o tutor.
Soluciones para ejercicios
La mayoría de las moléculas contienen enlaces covalentes polares y no polares. Dependiendo de la ubicación de los enlaces polares y la geometría de enlace, las moléculas pueden poseer una polaridad neta, llamada momento dipolar molecular. El agua, como probablemente recordarán, tiene un momento dipolar que resulta de los dipolos combinados de sus dos enlaces oxígeno-hidrógeno. El fluorometano también tiene un momento dipolar.
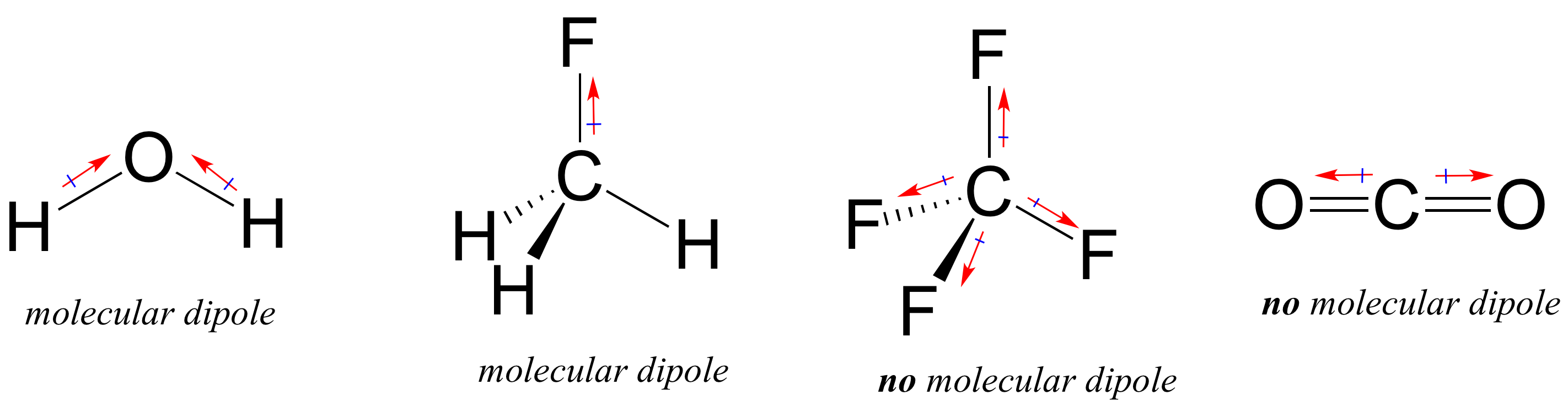
El tetrafluorometano, sin embargo, tiene cuatro enlaces polares que tiran igualmente hacia las cuatro esquinas de un tetaedro, lo que significa que aunque hay cuatro dipolos de enlace, no hay un momento dipolar molecular general. El dióxido de carbono también carece de un momento dipolar molecular.
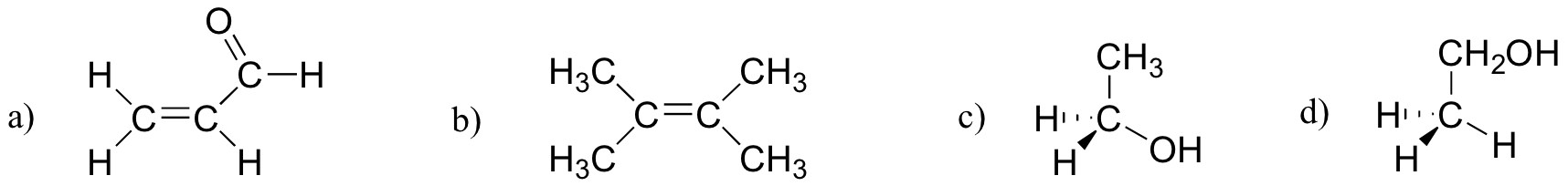
Ejercicio 2.27
¿Cuál de las moléculas de abajo tiene momentos dipolares moleculares?
Soluciones para ejercicios