Fisiopatología VIVA
Otros temas
Acuaporinas: Canales de agua
El agua atraviesa las membranas celulares por dos vías: por difusión a través de la bicapa lipídica y a través de canales de agua llamados acuaporinas. La caracterización funcional de la primera acuaporina se informó en 1992, pero se sospechó que los canales de agua existían mucho antes de ese momento, porque la permeabilidad osmótica de algunos tipos de células epiteliales era demasiado grande para explicarse por la difusión simple a través de la membrana plasmática.
Un único canal de acuaporina-1 humana facilita el transporte de agua a una velocidad de aproximadamente 3 mil millones de moléculas de agua por segundo. Dicho transporte parece ser bidireccional, de acuerdo con el gradiente osmótico predominante.
Las acuaporinas clásicas transportan agua libre de soluto a través de las membranas celulares; parecen ser canales de agua exclusivos y no penetran en las membranas a iones u otras moléculas pequeñas. Algunas acuaporinas, conocidas como aquagliceroporinas, transportan agua más glicerol y algunas otras moléculas pequeñas.
La familia de acuaporinas
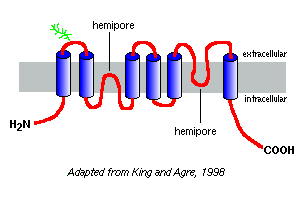
Hasta la fecha se han identificado más de 10 acuaporinas de mamíferos diferentes, y se sospecha que existen otros miembros. Se han aislado proteínas de canales de agua estrechamente relacionadas de plantas, insectos y bacterias. La acuaporina-1 de los glóbulos rojos humanos fue la primera en ser descubierta y es probablemente la mejor estudiada.
Las gráficas de hidrofobicidad de sus secuencias de aminoácidos predicen que las acuaporinas tienen seis segmentos que abarcan la membrana, como se muestra en el modelo de acuaporina-1 a la derecha.
Basado en estudios con acuaporina-1, parece que las acuaporinas existen en la membrana plasmática como homotetrámeros. Cada acuaporina monómero contiene dos hemi-poros, que se pliegan para formar un canal de agua.
Diferentes acuaporinas tienen diferentes patrones de glicosilación. En el caso de la acuaporina-1, la columna vertebral del péptido es de aproximadamente 28 kDa y las formas glicosiladas varían de 40 a 60 kDa en masa. La mayoría de las acuaporinas tienen un motivo de fosforilación de la proteína quinasa A en uno de los bucles citoplásmicos, y se sospecha que la fosforilación diferencial es una función reguladora de la molécula.
Patrones de Expresión de Acuaporinas
Cada una de las acuaporinas tiene un patrón de expresión esencialmente único entre los tejidos y durante el desarrollo. En la siguiente tabla se presenta un resumen de estos atributos y algunas de las funciones potenciales o conocidas importantes:
| Principales sitios de expresión | ||
|---|---|---|
| Aquaporin-0 | Eye: células de fibra de lente | Equilibrio de fluidos dentro del lente |
| Acuaporina-1 | Glóbulos rojos | Protección osmótica |
| Riñón: proximal tubule | Concentration of urine | Eye: ciliary epithelium | Production of aqueous humor | Brain: choriod plexus | Production of cerebrospinal fluid | Lung: alveolar epithelial cells | Alveolar hydration state |
| Aquaporin-2 | Kidney: collecting ducts | Mediates antidiuretic hormone activity |
| Aquaporin-3 * | Kidney: collecting ducts | Reabsorbtion of water into blood |
| Trachea: las células epiteliales | la Secreción de agua en la tráquea | |
| Acuaporina-4 | Renal: la recogida de los conductos | la Reabsorción de agua |
| Cerebro: las células ependimarias | líquido cefalorraquídeo (LCR) balance | |
| Cerebro: el hipotálamo | Osmosensing función? | |
| Pulmón: el epitelio bronquial | Bronquial secreción de líquido | |
| Acuaporina-5 | glándulas Salivales | la Producción de saliva |
| las glándulas Lagrimales | Producción de lágrimas | |
| Acuaporina-6 | Renal | Muy baja permeabilidad al agua; a la función? |
| Acuaporina-7 * | las células de Grasa | Transportes de glicerol de los adipocitos |
| los Testículos y el esperma | ||
| Acuaporina-8 | los Testículos, páncreas, hígado, otros | |
| Acuaporina-9 * | Leucocitos | |
| * un aquaglyceroporin | ||
Debe quedar claro que las acuaporinas son muy ampliamente distribuido, y también que los diferentes acuaporinas tienen diferentes funcionalmente importante especialidades.
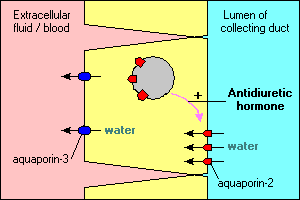
Varias características interesantes e importantes del transporte de agua mediado por acuaporinas se ilustran en las células principales que recubren los conductos colectores en el riñón. El agua que fluye a través de estos conductos puede continuar y eliminarse en la orina o reabsorberse a través del epitelio y volver a la sangre. La reabsorción es esencialmente nula a menos que las células epiteliales vean hormona antidiurética, que estimula fuertemente la reabsorción de agua. Las células de los conductos colectores expresan al menos dos acuaporinas:
- La acuaporina-2 se sintetiza pero, en ausencia de hormona antidiurética, reside en un grupo de vesículas de membrana dentro del citoplasma. La unión de la hormona antidiurética a su receptor en la célula no solo estimula la transcripción del gen de la acuaporina-2, sino que hace que el grupo intracelular de acuaporina-2 se inserte en la membrana apical. La célula ahora es capaz de absorber de manera eficiente el agua del lumen del conducto.
- La acuaporina-3 se expresa constitutivamente en la membrana basolateral de la célula. Cuando el agua se inunda en la célula a través de los canales de acuaporina-2, puede salir rápidamente de la célula a través de los canales de acuaporina-3 y fluir hacia la sangre.
Acuaporinas y Enfermedades
Teniendo en cuenta la importancia del transporte de agua en una miríada de procesos fisiológicos, es de esperar que las lesiones en los genes de acuaporinas o la disfunción adquirida en las acuaporinas puedan causar o contribuir a varios estados de enfermedad. La búsqueda de tales conexiones aún es temprana, pero se han identificado dos ejemplos claros de enfermedad como resultado de la deficiencia de acuaporinas:
- Las mutaciones en el gen de la acuaporina-2 causan diabetes insípida nefrogénica hereditaria en humanos.
- Los ratones homocigotos para inactivar mutaciones en el gen de la acuaporina-0 desarrollan cataratas congénitas.
- La obesidad de inicio en adultos se desarrolla en ratones homocigotos para inactivar mutaciones en el gen acuaporina-7, presumiblemente debido a la ineficiencia en el transporte de glicerol de las reservas de triglicéridos hidrolizados.
Se ha identificado un pequeño número de personas con deficiencia severa o total de acuaporina-1. Curiosamente, parecen clínicamente no afectados, pero no han sido examinados en condiciones de privación de agua. Los ratones con deleciones específicas en acuaporina – 1 también parecen normales y saludables a menos que tengan restricción de líquidos, en cuyo caso se vuelven severamente hiperosmolares.
Referencias y revisiones
- Borgnia M, Nielsen S, Engel A, Agre P: Biología celular y molecular de los canales de agua acuaporina. Annu Rev Biochem 68: 425, 1999.
- DeGroot BL, Grubmuller H: Permeación de agua a través de membranas biológicas: Mecanismo y dinámica de acuaporina-1 y GlpF. Ciencia 294:2353, 2001.
- Hibuse T, Proc Nat Acad Sci (USA) 102:10993, 2005.
- King LS, Agre P: Fisiopatología de los canales de agua acuaporina. Annu Rev Physiol 58: 619, 1998.
- Knepper MA, Inoue T: Regulación del tráfico de canales de agua acuaporina-2 por vasopresina. Curr Opinion Cell Biol 9: 560, 1997.
- Lee MD, King LS, Agre P: La familia de acuaporinas de proteínas de canales de agua en medicina clínica. Medicine 76: 141, 1997.
- Preston GM, Carroll TP, Guggino WP Agre P: Aparición de canales de agua en ovocitos Xenopus que expresan proteína CHIP28 de glóbulos rojos. Science 256: 385, 1992.
- Sasaki S, Ishibashi K, Marumo F: Acuaporina-2 y -3: Representantes de dos subgrupos de la familia de las acuaporinas colocados en el conducto colector renal. Annu Rev Physiol 60: 199, 1998.