Hechos, Resumen & Definición
- Un aducto es un producto formado por una reacción de adición
- Los aductos solo se pueden formar a partir de reactivos que tienen enlaces múltiples, como alquenos y grupos carbonilos
- Los aductos se pueden formar a través de dos tipos de reacción de adición: los aductos electrofílicos y nucleofílicos
- a menudo se forman entre los ácidos de Lewis y las bases de Lewis
¿Qué es un aducto?
Un aducto es un producto formado al final de una reacción de adición. Esta es una reacción en la que dos o más moléculas reaccionan y se combinan para formar un producto más grande. Este tipo de reacción solo puede ocurrir entre compuestos químicos que tienen enlaces múltiples, compuestos como alquenos (enlaces dobles) y alquinos (enlaces triples). Los grupos carbonilo (C = O) e imina (C=N) también pueden experimentar reacciones de adición, y por lo tanto formar aductos.
¿Cómo se forman los aductos?
Como se mencionó anteriormente, los aductos se forman a través de reacciones de adición. En este tipo de reacción, el doble enlace se rompe parcialmente cuando una molécula que reacciona ataca y aumenta. La reacción a continuación muestra una reacción de adición entre el eteno y el bromo.

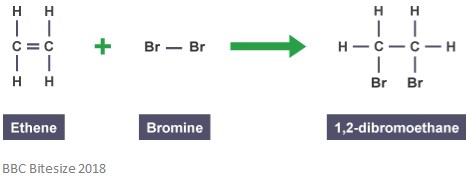
El aducto en esta reacción es de 1,2-dibromoetano. Esto se debe a que es una especie distinta que contiene todos los átomos de todos los componentes.
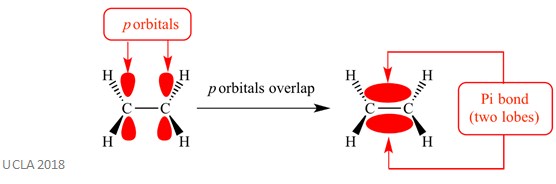
Estas reacciones de adición generalmente involucran enlaces pi (π). Este es un tipo complejo de enlace en el que los orbitales p de los átomos adyacentes se superponen, es esta superposición la que causa el enlace pi. Esto ocurre perpendicular a cualquier enlace sigma entre esos dos mismos átomos. Este enlace pi también tiene dos lóbulos orbitales: uno está por encima del plano del enlace sigma y el otro está por debajo del plano del enlace sigma. El enlace pi se muestra en el siguiente diagrama.

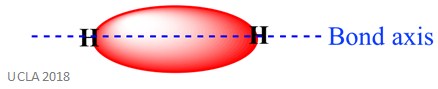
de La misma reacción también puede implicar sigma ( ∑ ) de los bonos. Este es un tipo de forma de enlace covalente por la superposición de orbitales atómicos a lo largo del eje de enlace, en otras palabras, a lo largo de la línea que conecta los dos átomos enlazados. Por ejemplo, el enlace sigma en un átomo de hidrógeno se forma por la superposición de dos orbitales 1s, uno de cada átomo de hidrógeno. Esto se muestra mejor en la imagen de abajo, el área roja que muestra el enlace sigma.

Hay dos tipos principales de reacción de adición: adición electrofílica y la adición nucleófila.
Adición electrofílica
Una reacción de adición electrofílica es un tipo de reacción en la que se rompe un enlace y se forman dos enlaces nuevos. Como se discutió anteriormente, el reactivo debe tener un enlace doble o triple, el electrófilo se suma a un enlace pi en este caso. Esta es una reacción de adición, por lo que no se pierde nada en el proceso: todos los átomos que se encuentran en las moléculas del reactivo también se encuentran en el aducto.

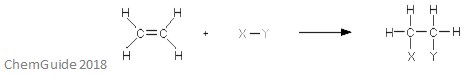
La imagen de arriba muestra la base de una reacción de adición electrófila. Como pueden ver, todos los átomos de los reactivos se encuentran en el aducto.
Adición nucleofílica
Una reacción de adición nucleofílica es un tipo de reacción en la que se rompe un enlace doble y se forman dos enlaces simples. Un enlace doble o triple con deficiencia de electrones (electrofílico) reacciona con algo rico en electrones (nucleófilo). El nucleófilo se suma a un enlace pi en este caso. A continuación se muestra un ejemplo de una reacción de adición nucleofílica.

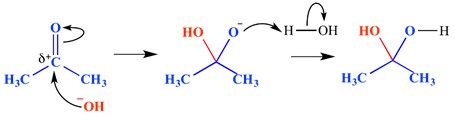
En este ejemplo, se ha agregado un ion hidróxido al extremo delta positivo del grupo carbonilo, esto ha formado una molécula intermedia tetraédrica oxianiónica. El resultado final es, por lo tanto, la adición de agua a través del enlace pi del grupo carbonilo.
Ácidos y bases de Lewis
Los aductos a menudo se forman entre ácidos de Lewis y bases de Lewis. La molécula formada se llama aducto ácido-base de Lewis (o complejo ácido-base de Lewis). Como los aductos solo se forman a través de reacciones de adición (es decir, sin la pérdida simultánea de un grupo), las reacciones de ácido y base de Lewis no pueden ser del tipo de sustitución.
Un buen ejemplo de esto es la reacción entre THF y BH3, que se muestra en la imagen de abajo. Como verán, estos aductos ácido-base de Lewis se muestran con puntos, que representan electrones.

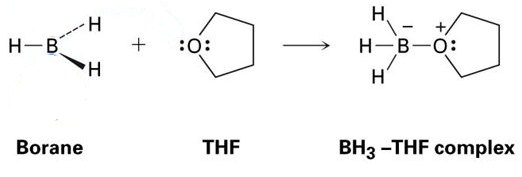
Como puede ver, el único producto que se forma es el BH3-THF complejo, lo que significa que es un aducto.
Estos tipos de reacciones también se pueden representar con flechas, estas flechas representan la donación de electrones de la base al ácido. La misma reacción se muestra a continuación, pero con flechas para indicar la donación de electrones.

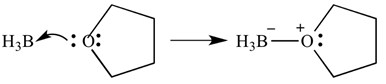
es importante señalar aquí que estas flechas tienen dos ‘barbas’ en la punta. Esto indica que se ha donado un par de electrones. Si solo se dona un electrón, la flecha solo tendrá un bardo en el extremo puntiagudo.
En este caso, el ácido de Lewis es borano y la base de Lewis es THF. Como pueden ver, la base ha donado un par solitario de electrones al ácido para formar un enlace oxígeno-boro.
Los compuestos que no pueden formar aductos debido a la forma de las moléculas se denominan pares de Lewis frustrados.
Leer Más
http://www.chem.ucla.edu/~harding/IGOC/L/lewis_acid_base_adduct.html