Biomateriales
Es posible delimitar el estudio de biomateriales a través de una definición muy general pero coherente por Parque y Lagos . Según ellos, un biomaterial se puede definir como cualquier material utilizado en la fabricación de dispositivos para reemplazar parte o función del cuerpo de una manera segura, confiable, económica y fisiológicamente aceptable.
Para realizar satisfactoriamente la función de reemplazar, ampliar o soportar una estructura, el implante debe imitar o coincidir con las características del tejido. La literatura reporta la existencia de diferentes tipos de injertos óseos utilizados en implantes: autólogos (derivados del mismo individuo); homólogos (de un individuo de la misma especie del receptor); y heterólogos (cuando las especies del donante y del receptor no son las mismas – ganado, por ejemplo).
Los injertos autólogos tienen ciertos inconvenientes, por ejemplo: intervención en un área sana del cuerpo del paciente; morbilidad en el área donante, mayor período de recuperación; susceptibilidad a infecciones; y reabsorción progresiva y constante . Por lo tanto, los implantes en biomateriales sintéticos como cerámica y polímeros se han desarrollado y aplicado ampliamente. Según Pereira, Buono y Zavaglia, la demanda de biomateriales ha crecido del 5 al 15% cada año.
Clasificación de biomateriales
Según Bath y Santos , los biomateriales se pueden clasificar en cuatro clases, de acuerdo con la compatibilidad que tienen con los tejidos circundantes:
Biotolerante: Implante separado del hueso circundante por una capa de tejido blando sobre la interfaz. No hay contacto en la osteogénesis. La capa es inducida por la liberación de monómeros, iones y/o productos de corrosión del implante. Casi todos los polímeros sintéticos y la mayoría de los metales pertenecen a esta categoría.
Bioinertes: Implantes en contacto directo con tejido óseo, que se producen en la osteogénesis. Sin embargo, no hay reacción química entre el tejido y el implante. No hay, al menos en cantidades detectables por las células, la liberación de ningún componente. Ejemplos de biomateriales bioinert son: alúmina, zirconia, titanio, tántalo, niobio y carbono.
Bioactivo: existe la interacción entre el implante y el tejido óseo, interfiriendo directamente en la osteogénesis. Por similitud química, la parte mineral del tejido óseo se une al implante, promoviendo la osteoconducción. Los principales materiales de esta clase son: Ca-fosfato, cerámica vitro e hidroxiapatita.
Bioabsorbible: Materiales que, después de un cierto período de tiempo en contacto con los tejidos, terminan siendo degradados, solubilizados o fagocitados por el cuerpo. Son de interés en aplicaciones clínicas donde no es aconsejable la reapertura para retirar el implante. Representativos de esta clase son el fosfato tricálcico (TCP) y el PLLA (ácido poli-L-láctico).
Biomateriales metálicos
A veces, el cuerpo tolera elementos metálicos en sus formas naturales y en pequeñas cantidades, como el hierro (Fe) en los glóbulos rojos, el cobalto (Co) en la síntesis de vitamina B12 y en los enlaces cruzados de la elastina presente en la arteria aórtica . Sin embargo, en grandes cantidades, la mayoría de los metales no son tolerados por el cuerpo.
Algunos metales se utilizan como sustitutos de tejidos duros, por ejemplo, en reemplazos totales de cadera y rodilla, placas y tornillos para la fijación de fracturas, dispositivos de fijación de columnas e implantes dentales debido a sus excelentes propiedades mecánicas y resistencia a la corrosión . Según Barbucci, un material metálico utilizado en la construcción de prótesis ortopédicas, dispositivos de osteosíntesis e implantes dentales debe tener las siguientes características:
- Resistencia límite igual o superior a 800 MPa;
- Resistencia a la corrosión (local y general);
- Biocompatibilidad.
Biocompatibilidad no es un efecto o un fenómeno único. Se refiere a una serie de procesos que implican diferentes mecanismos de interacción, pero interdependientes, en relación con los materiales y los tejidos. Es la capacidad del material para realizar una función específica en el cuerpo sin causar efectos tóxicos o perjudiciales en los sistemas biológicos .
Estas características son tan restrictivas que solo se puede utilizar con éxito un pequeño número de clases de materiales metálicos.
La primera aleación desarrollada específicamente para el uso en el cuerpo humano fue el «acero de vanadio», utilizado para la fabricación de placas y tornillos para fracturas óseas . Entre los biomateriales metálicos, los aceros inoxidables austeníticos de tipo 316 LVM, las aleaciones Co-Cr-Mo, Co-Ni-Cr-Mo, titanio puro y Ti-6Al-4V son los más utilizados . En la Figura 1 se muestran algunos ejemplos.

Figura 1: Dispositivos metálicos de aplicación médica: a) Cabeza femoral; b) rodilla de articulación superior; c) Placa de articulación mandibular.
En este trabajo, abordaremos más específicamente las aleaciones Co y Ti, cuya aplicación en el prototipado rápido de DMLS en el campo médico es más expresiva.
Aleaciones de cobalto
Las aleaciones de cobalto se propusieron originalmente para implantes quirúrgicos hace más de 70 años . Hay básicamente dos tipos de aleaciones de Co para aplicaciones médicas. La aleación Co-Cr-Mo para revestimiento y las aleaciones trabajadas Co-Ni-Cr-Mo . La American Society for Testing and Materials (ASTM) enumera cuatro aleaciones de Co que se recomiendan para su uso en implantes quirúrgicos: aleación de recubrimiento Co-Cr-Mo (F75) y aleaciones trabajadas Co-Cr-W-Ni (F90), Co-Ni-Cr-Mo (F562) y Co-Cr-Mo (F1537).
Estas aleaciones son una clase de materiales altamente resistentes a la corrosión en entornos fisiológicos y al desgaste, superando al acero inoxidable . Además, su límite de resistencia superior y resistencia a la fatiga permiten su aplicación donde se requiere una larga vida útil sin la aparición de fracturas o estrés/fatiga . Muchas propiedades se originan de la naturaleza cristalográfica del cobalto, el efecto potenciador de Cr y Mo, y la formación de carburos de alta dureza .
Estas características especiales han llevado al uso de estas aleaciones en diversas aplicaciones médicas, particularmente en aquellas que tienen como objetivo reemplazar las superficies articulares. Sus propiedades de resistencia al desgaste, corrosión y bajo coeficiente de fricción son decisivas en esta elección.
Un ejemplo de aplicación es la Artroplastia Total de Cadera (THA). Los sistemas más nuevos consisten en una varilla femoral unida a una cabeza modular sujeta a coordinación con el componente acetabular . Este sistema se conoce como MoM (metal sobre metal), en referencia a la superficie de contacto, y es mejor que los sistemas MoP (metal sobre polietileno), utilizados en relación con la velocidad volumétrica de desgaste y otros parámetros hasta el momento, como se informa en . La Figura 2 muestra un ejemplo de los sistemas MOP y MoM para THA.

Figura 2: izquierda: MoP; a la derecha: Mamá.
Otro ejemplo de aplicación de aleaciones de Co, a las que este trabajo está directamente relacionado, es la reconstrucción total de la articulación temporomandibular. Este tipo de prótesis, conocida como prótesis de Christensen, ha estado en uso durante más de 30 años y se caracteriza por la promoción de una reconstrucción estable, confiable y predecible, proporcionando la reducción en el nivel de dolor, la mejora en la funcionalidad y un mayor grado de movimiento . La Figura 3 ilustra una prótesis temporomandibular.
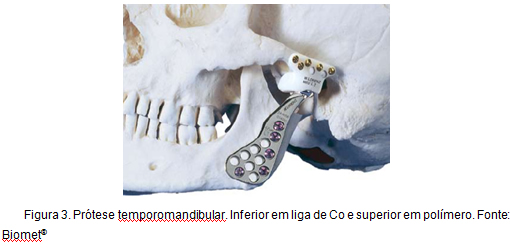
Figura 3: Temporomandibular prótesis.
Aleaciones de titanio
Descubierto en 1791 por William Gregor, un mineralogista británico, el titanio, y más recientemente, sus aleaciones, se ha utilizado durante décadas en la fijación de fracturas y la reconstrucción de articulaciones, ya que cumple con los requisitos necesarios para aplicaciones biomédicas, como: resistencia al desgaste, biocompatibilidad, bioadhesión( inducción del crecimiento óseo), módulo de elasticidad (cuanto más cerca del hueso humano – 10-30 GPa -, mejor), resistencia a la fatiga y buena procesabilidad.
El titanio tiene una estructura hexagonal empaquetada cerrada (hcp) relacionada con la fase alfa, que puede sufrir un cambio alotrópico a 881º C para la estructura cúbica centrada en el cuerpo (bcc) conocida como fase beta. La manipulación de estas características cristalográficas mediante la adición de aglutinantes y procesos termomecánicos permite la obtención de aleaciones con diversas propiedades.
Las clases de titanio que se introdujeron inicialmente como biomateriales fueron ASTM F67 (titanio comercialmente puro en grados 1, 2, 3 y 4), ASTM F136 (aleación Ti-6Al-4V Intersticial Extra Baja) y ASTM F1472 (aleación Ti-6Al 4W-estándar) . En estos materiales, algunos elementos de aleación estabilizan la fase alfa, mientras que otros estabilizan la fase beta. Se puede estabilizar la fase alfa incluyendo aluminio, estaño y circonio, mientras que la fase beta se puede estabilizar con vanadio, molibdeno, niobio, cromo, hierro y manganeso . Se observa, por lo tanto, que la aleación ASTM F136 es un ejemplo de aleación alfa/beta estabilizada.
Parte de la resistencia al desgaste observada en el titanio y sus aleaciones se debe a la formación de una capa de óxido pasiva que consiste principalmente en TiO2 que se adhiere a la superficie del metal y lo protege, además de ser en gran parte responsable de la biocompatibilidad del material. Esta capa se puede obtener por oxidación anódica en electrolito de ácido acético y, cuando se evalúa la presencia de titanio en el tejido adyacente al implante, es sustancialmente menor en el implante anodizado en comparación con aquellos sin anodizado superficial , .
El trauma severo en la estructura facial requiere un gran número de placas y tornillos, y los implantes de titanio son particularmente adecuados, debido a las propiedades citadas en esta revisión. Hay placas y tornillos para la región cráneo-maxilofacial en varias configuraciones para que el médico pueda ajustar el sistema a la anatomía del paciente. La Figura 4 es un ejemplo de aplicación de titanio en la fijación de fracturas cráneo-maxilofaciales.

Figura 4: Placas para la fijación de fracturas cráneo-maxilofaciales.
Otra aplicación que demuestra la versatilidad del material se produce en las varillas intramedulares para fracturas de tibia cerradas y compuestas, donde el implante (Figura 5) está indicado para fracturas óseas más grandes y sometidas a mayores tensiones mecánicas (tibia).
Figura 5: Eje intramedular tibial en Ti.
Biomateriales cerámicos
El desarrollo de materiales cerámicos para aplicaciones biomédicas se centra principalmente en las áreas de ortopedia y odontología . Es una clase de materiales que incluye varias características de los biomateriales. Tiene representantes de las clases bioinertes, bioabsorbibles, bioactivas y porosas para el crecimiento de tejidos .
El potencial de las cerámicas como biomateriales proviene de su similitud con el entorno fisiológico, debido a su constitución básica de iones que también se encuentran en el entorno fisiológico (calcio, potasio, magnesio, sodio, etc.) y otros cuya toxicidad es muy limitada (circonio y titanio).
Las cerámicas bioinertes son más representativas en los compuestos de alúmina (Al2O3), zirconia (ZrO2) y zirconia estabilizada con óxido de itrio (ZrO2 (Y2O3)). Su capacidad de no reaccionar con el tejido circundante, resistencia a la corrosión, alta resistencia al desgaste y alta resistencia mecánica son características esenciales en su uso como superficies articuladas sujetas a cargas y fricción .
En el corazón de las cerámicas bioactivas y bioabsorbibles, se pueden encontrar compuestos como la hidroxiapatita (HA), los fosfatos de calcio, especialmente el fosfato β-tricálcico (β-TCP), así como los bioglóseos y vitrocerámicas, cuya composición está compuesta por una amplia gama de óxidos (SiO2, P2O5, CaO, CaF2, Na2O, Al2O3, Ta2O5, y TiO2, entre otros.) .
Park, J; Lakes, R. S.»Biomaterials – An Introduction». Springer. 3ª edición. 2007. p. 2.
Gália, C. A; et al. «Uso de injerto homólogo y heterólogo en diáfisis femoral de ratas: comparación entre injerto óseo congelado y liofilizado». Revista Brasileña de Ortopedia y Traumatología. Marzo de 2005.
Marzola, C; Toledo Filho, J. L. «fundamentos de la Cirugía Maxilofacial Oral-implantes de materiales aloplásticos»» Capítulo X.
Pereira, M. M; Buono, V. T. L ; Zavaglia, C. A. C. » Metallic Materials: Science and application as biomaterials. En: Orefice, R. A; Pereira, M. M; Mansur ,H. S. «Biomateriales: fundamentos y aplicaciones»» Río de Janeiro. Cultura médica, 2006, cap. 2, p. 39-58.
Bath, S. V. «Biomaterials”. Narosa Publishing House. Nova Dheli, Índia. 2002. p.181
Santos, L.A. «Desenvolvimento de fosfato de cálcio reforçado por fibras para uso na área médico-odontológica.” Tese de Doutorado. Universidade Estadual de Campinas. 2002.
Wong, J. Y; Bronzinho, J. D. «Biomaterials”. Taylor e Francis Group. LLC. 2007. p. 1-1.
Barbucci, R. «Integrated Biomateriais Science”. Kluwer Academic / Plenum Publishers. Nova Iorque.2002. cap. 6. p. 289-290.
Bertol, L. S. «Contribución al estudio de prototipado rápido, digitalización tridimensional y selección de materiales en el diseño de implantes personalizados»» Tesis de maestría. Universidad Federal de Rio Grande do Sul. Porto Alegre. 2008.
Donachie M. «Metals Handbook desk Edition». 2ª edición, editada por Davis, J. R. ASM International. 1998.
Disegi, J. A; Kennedy, R. L; Pilliar, R. «Cobalt-Base Alloys for Biomedical Application». ASTM-STP 1365. 1999.
Shi, D. «Introduction to Biomaterials». Tsinghua University Press, World Scientific. 2006. p-123.
Marti, A. «Aleaciones a base de cobalto utilizadas en cirugía ósea». Injury-Revista Internacional del cuidado de los Heridos. 2000 (31).
Wnek, G. E; Bowlin, G. L. «Encyclopedia of Biomaterials and Biomedical Engineering». Vol 2. 2ª edición. Informa Healthcare. 2008.
Sieber, H. P; Rieker, C. B ;Köttig, P. «Analysis of 118 second-generation metal-on-metal retrieved hip implants». The Journal of Bone & Cirugía de articulaciones (Br). 1998; 80-B: 46-50.
Garret, W. R; Abbey, P. A; Christensen, R. «Reconstrucción de la articulación temporomandibular con una prótesis de articulación temporomandibular total personalizada: Uso en el paciente operado por multiplicación». Una reimpresión de Surgical Technology International VI.
Leyens, C; Manfred, P. «Titanium and Titanium alloys: fundamentals and applications». Wiley-VCH. Primera edición. 2003. p-1.
Yaszemski, M. J; Tantrolo, D. J; Lewandrowski, K; Hasirci, V; Altobelli, D. E; Wise, D. L. «Biomaterials in orthopedics». Marcel Dekker Inc. 2004. p-2.
Lütjering, G; Williams, J.C. » Titanium-Engineering Materials and Processes. Springer-Verlag. Segunda edición. 2003. p-399.
Brown, S.A.; Lemons, J. E. «Medical applications of titanium and its alloys: the material and biological issues». Actas de un simposio celebrado en 1994 en Phoenix, Arizona. STP 1272. ASTM. 1996.
Brunette, D. M; Tengvall, P; Textor, M; Thomsen, P. «Titanium in medicine: material science, surface science, engineering, biological responses and medical applications». Springer-Verlag. 2001. p – 28.
Larsson, C; Thomsen, P; Aronsson, B. O; Rodahl, M; Lausmaa, J; Kasemo, B; Ericson, L. E. «La respuesta ósea a la superficie modificada implantes de titanio: estudios sobre la respuesta de los tejidos a mecanizar y electropulido implantes con diferentes óxido de espesores». Biomaterias 17 (1996) 605-616. Elsevier .
Jorgenson D. S; Centeno, J. A; Mayer M. H; Topper, M. J; Nossov, P. C; Mullick, F. G; Manson, P. N. «Respuesta biológica a la disolución pasiva de microplacas craneofaciales de titanio». Biomaterials 20 (1999) 675-682. Elsevier.
Zimmer Sirus® – Sistema de Uñas Intramedulares. Zimmer, 2007.
Shakelford, J. F. «Bioceramics – Advanced ceramics; v. 1». Gordon and Breach Science Publishers, 1999. p – 5.
Hench, L. L. «Bioceramics: From concept to Clinic». J. Am. Ceram. Soc., 74 (7) 1487-510 (1991).
Hench, L. L; Wilson, J. «An introduction to Bioceramics». World Scientific Publishing Co, 1993. p – 25.
Bubok, V. A. «Biocerámicas – Ayer, Hoy, Mañana». Pulvimetalurgia y Cerámica Metálica, Vol. 39, Nos. 7 y 8, 2000.
Prótesis personalizables
Reconstrucción cráneo-maxilofacial mediante prototipado rápido
El prototipado rápido es la técnica de fabricación de piezas por método aditivo. Un modelo 3D creado en un sistema CAD se divide en perfiles 2D que luego se construyen mediante equipos de creación rápida de prototipos capa por capa. Varias técnicas están disponibles en la actualidad, como: estereolitografía (SLA), Sinterización Láser de Metal Directo (DMLS), Fusión de Superficie Láser (LSM), Modelado por Deposición Fundida (FDM), impresión 3D (3DP) y Soldadura por Haz de Electrones (EBW) .
En la primera década de uso de la técnica DMLS, de 1994 a 2004, estuvo dominada, al menos en sus aplicaciones comerciales, por materiales desarrollados específicamente para el proceso DMLS, es decir, con enfoque en mejoras en la procesabilidad y propiedades aceptables para las aplicaciones más comunes. Hoy en día, una amplia gama de aleaciones está disponible para su uso en DML, como aleaciones ligeras de titanio. De especial interés en el área médica son el Ti-6Al – 4V-titanio, aluminio, vanadio y Ticp-titanio comercialmente puro. Ambos se caracterizan por sus excelentes propiedades mecánicas, resistencia a la corrosión, bajo peso específico y, especialmente, por su biocompatibilidad .
Tradicionalmente, el prototipado rápido (RP) se utiliza en la industria y la ingeniería como un medio para producir prototipos confiables en poco tiempo, lo que genera ganancias en costos . Recientemente, RP ha extendido su aplicación más allá de los productos de ingeniería. Su uso en el campo médico para la fabricación de implantes y prótesis personalizados, el estudio de la anatomía y la planificación quirúrgica incluyen importantes campos de investigación . El atractivo en el campo de la medicina se produce frente a obstáculos significativos, como el hecho de que un caso nunca es igual entre sí, por lo que la estandarización en la producción de implantes no es ventajosa, y los problemas relacionados con los puntos oscuros de la región de la cirugía dificultan la planificación quirúrgica .
Entre los defectos congénitos, las anomalías craneofaciales (AFC) son un grupo muy diverso y complejo que afecta a una proporción significativa de personas en el mundo .
Además de los casos de deformidades congénitas, hay defectos craneofaciales adquiridos debido a otros trastornos, por ejemplo, tumores. En las últimas cuatro décadas, también se ha observado un creciente volumen de casos de traumatismos faciales, que está estrechamente relacionado con el aumento de los accidentes automovilísticos y la violencia urbana.
En todos los casos, la rehabilitación cráneo-maxilofacial es parte del proceso de reintegración de los pacientes en la sociedad y la promoción del bienestar.
Creación rápida de prototipos en la reconstrucción del cráneo y la cara
El medio convencional de fabricación de un implante para la reparación de defectos craneales consiste en el modelado directo del implante en el sitio quirúrgico durante la cirugía. La impresión se realiza en cera y posteriormente se utiliza en la fabricación de un molde de biomaterial . A finales de la década de 1980, aparecieron los resultados de la primera investigación que trató de encontrar una manera de producir un modelo físico directamente a partir de un modelo digital tridimensional .
El prototipado rápido es un método de fabricación capa por capa que puede producir geometría compleja a partir de un modelo CAD .
Su uso en aplicaciones médicas ha revolucionado la planificación de cirugías complejas a través de la construcción de modelos anatómicos preoperatorios que permiten al personal médico tener una evaluación crítica de cada caso particular . También ha recibido gran énfasis en su uso en la fabricación personalizada de implantes para la reconstrucción del cráneo y defectos faciales , , , , .
En la construcción de implantes personalizados, se requiere la entrada de los datos de los pacientes. Los datos se obtienen de CT o NMRI en cortes transversales 2D en formato DICOM, cuyo grosor se determina en el equipo al obtener las imágenes. El número de cortes es lo que determina la resolución de la imagen y, por lo tanto, el modelo 3D. Los cortes 2D se transfieren al software de modelado médico donde es posible ajustar la señal de umbral para obtener, después de la interpolación, una representación 3D de la estructura ósea,.
Después de la obtención del modelo, se puede manejar en un software CAD para el modelado del implante que reparará el defecto óseo.
El sólido modelado se convierte luego al formato STL y se puede crear un prototipo mediante cualquier técnica de creación rápida de prototipos.
Aplicaciones, materiales e informes de casos recientes
En el área de reparación cráneo-maxilofacial, se han reportado varios casos de aplicación exitosa de tecnologías de modelado 3D y creación rápida de prototipos para tener implantes personalizados.
Bertol et al. reportó el uso de imágenes de tomografía para obtener un modelo virtual en 3D para el procedimiento de resección virtual de parte de la mandíbula afectada por un tumor y el diseño de implante posterior para reemplazar la región afectada por la técnica de espejado por plano de simetría, donde la parte sana de la mandíbula se refleja y se usa en la reconstrucción de la región extirpada.
Figura 7: Proceso de obtención del modelo 3D y el implante (a la izquierda). Implante construido por DMLS (a la derecha) .
El implante fue construido en titanio (Ti-6Al-4V) mediante el uso de la técnica de Sinterización Láser de Metal Directo (DMLS). En este proceso, el metal en polvo se funde en una pieza sólida a través de la fusión local proporcionada por un rayo láser de alta energía dirigido por computadora de acuerdo con el diseño de la pieza.
Después de la fabricación del implante, se escaneó mediante la técnica de escaneo 3D para la comparación dimensional con el modelo virtual. Las diferencias no fueron mayores de 0,05 mm, lo que demuestra la precisión del método.
Drstvensek et al también reportaron casos exitosos que demuestran el gran potencial del prototipado rápido en el campo médico. En un caso notificado, se trató una asimetría facial grave (microsomía hemifacial). La metodología utilizada fue similar a la utilizada por Bertol et al. Los modelos 3D se obtuvieron a partir de imágenes de TC y el implante se desarrolló en un entorno virtual reflejando la parte no afectada.
Figura 8: Modelo virtual del área a construir (a la izquierda); Implante fabricado por DMLS .
En otro caso reportado por Drstvensek et al, se utilizaron las mismas técnicas en la fabricación de un implante de cráneo y escaneo 3D posterior para control dimensional. En comparación con el modelo virtual, el implante mostró variaciones de 0,8 a 1,0 mm en algunas regiones. Según el autor, debido a que la región en cuestión no se encuentra en una parte crítica, el implante fue aprobado e implementado con éxito. La técnica de prototipado utilizada en ambos casos fue DMLS y el material fue Ti-6Al-4V.
Figura 9: Prótesis fabricada por DMLS (a la izquierda). Resultado de la inspección geométrica virtual (a la derecha).
Recientemente, varios estudios se han centrado en la asociación de propiedades en la fabricación de implantes. Esto ocurre, por ejemplo, en la combinación de propiedades de resistencia mecánica y corrosión del titanio con la bioactividad de cerámicas como HA y α-TCP.
Ning y Zhou, evaluaron la bioactividad in vitro e in vivo del biocompuesto fabricado a partir de polvos de HA y Ti por el método metalúrgico del polvo. Mezclas en varias proporciones de HA/Ti se mezclaron y sintetizaron a 1200 ° C. Los resultados muestran que los compuestos con el mayor contenido de Ti tienen la capacidad de inducir la nucleación y el crecimiento de apatita en su superficie, que proporcionan crecimiento óseo y hacen que los biocompuestos metálicos/cerámicos sean candidatos para el reemplazo óseo.
Kim et al depositaron películas densas y uniformes de HA y FHA (hidroxiapatita-fluoro) con un grosor de ~ 5 µm en sustratos de titanio utilizando la técnica sol-gel. El sustrato presentó crecimiento favorable y proliferación de osteoblastos, aumentando la actividad y función del sustrato.
En la misma línea de trabajo, Bertol reportó dos casos con la asociación de Ti y α-TCP. Se obtuvo un implante personalizado mediante moldeo manual en el modelo físico del paciente obtenido a partir de imágenes tomográficas (suelo orbital), mientras que el otro se mecanizó de acuerdo con el diseño virtual también obtenido a partir de imágenes tomográficas (mandíbula). En ambos casos, los implantes se recubrieron con α-TCP y se implementaron con éxito.
Figura 10:
No solo el titanio, sino también las aleaciones de co han estado utilizando compuestos cerámicos para mejorar algunas de sus propiedades. Yen et al reportan el recubrimiento electrolítico de una aleación Co-Cr-Mo con ZrO2 a una prótesis de cadera. En este caso, la aplicación del recubrimiento redujo el desgaste del componente metálico contra el componente polimérico y disminuyó el coeficiente de fricción entre las superficies.
Khan, S. F.; Dalgarno K. W. «Design of customized Medical Implants by Layered Manufacturing» (en inglés). Escuela de Ingeniería Mecánica y de Sistemas. NC University-Reino Unido.
Ma, D ;Lin F; Chua C. K. » Aplicaciones de prototipado rápido en Medicina. Part 1: NURBS-Based Volume Modelling»(en inglés). The International Journal of Advanced Manufacturing Technology (en inglés). Springer-Verlag London Limited (en inglés). 2001
Lima, B. C. «Engenharia Invierte e Prototipagem Rápida: Estudo de Casos». pp 15-16. 2003.
Shellabear, M; Nyrhilä, O.»DMLS – Development History and State of the Art». LANE, Erlanger. 2004.
Shellabear, M; Nyrhilä, O. «Advances in Materials and Properties of Direct Metal Laser-Syntered Parts». LANE, Erlanger. 2004.
Molleó, I. L. «anomalías craneofaciales, Genética y Salud Pública: contribuciones al reconocimiento de la situación actual del cuidado en el Sistema Único de Salud»» Unicamp. 2004.
Lima Silva, J. J. de; Lima, A. A. A. S.; Torres, S. M. «fracturas faciales: análisis de 105 casos»» Revista Brasileira de Cirurgia Craneomaxilofacial / Asociación Brasileña de Cirugía Cráneo-Maxilofacial. – Vol.12, No. 1 (Jan.2009).
Gopakumar, S. » RP en medicina: un estudio de caso en cirugía reconstructiva craneal»» Diario de Prototipado Rápido. Volumen 10 * Número 3 * 2004 * pp 207-211.
Bertol, L. S. «contribución al estudio de prototipado rápido, digitalización tridimensional y selección de materiales en el diseño de implantes personalizados»» Tesis de maestría. Universidad Federal de Rio Grande do Sul. Porto Alegre. 2008.
Naber, H. «Advances in rapid prototyping technologies», Conferencia sobre Materiales y Fabricación, Metalex, Tailandia. 1998.
Gibson, I; Cheung, L. K; Chow, S. P; Cheung, W. L; well, S. L; Savalani, M; Lee, S. H.»The use of rapid prototyping to assist medical applications» (en inglés). Rapid Prototyping Journal 12/1 (2006) 53-58.
Hench, L. L. «Bioceramics: From concept to Clinic». J. Am. Ceram. Soc., 74 (7) 1487-510 (1991).
Wu, W; Shang, Y; Li, H; Wang, W. «Fabrication of repairing skull bone defects based on the rapid prototyping». Journal of Bioactive and Compatible Polymers, Vol. 24-May 2009.
Bertol, L. S; Junior, W. K; Silva, F. P. d.; Aumund-Kopp, C. «Medical design: Direct metal laser sintering of Ti-6Al-4V». Materiales y diseño (2010), doi: 10.1016 / j.matdes.2010.02.050.
Oliveira, R. S. d; Brigato, R; Madureira, J. F. G; Cruz, A. A. V; Filho, F. V. d. M; Alonso, N; Machado, H. R.»Reconstruction of a large complex skull defect in a child: a case report and literature review». Childs Nerv Syst (2007) 23:1097-1102.
Drstvensek, I; Hren, N. I; Strojnik, T; Brajlih, T; Valentan, B; Pogacar, V; Hartner, T. Z. «Aplicaciones de Prototipado rápido en Procedimientos de Cirugía Cráneo-Maxilofacial». Revista Internacional de Biología e Ingeniería Biomédica. Issue 1, volume 2, 2008.
Ning, C. Q; Zhou, Y. » Bioactividad in vitro de un biocompuesto fabricado a partir de polvos de HA y Ti por método de pulvimetalurgia. Biomaterials 23 (2002) 2909-2915.
Ning, C. Q; Zhou, Y. «Correlaciones entre la bioactividad in vitro e in vivo de los compuestos de Ti / HA fabricados por un método de pulvimetalurgia». Acta Biomaterialia 4 (2008) 1944-1952.