Sir,
Los carcinomas de células escamosas (CCE) de la piel son tumores cutáneos malignos frecuentes, con una incidencia de 30 por cada 100.000 habitantes al año en Europa occidental. En climas más soleados son aún más frecuentes. El CCE generalmente se desarrolla a partir de queratosis actínicas. Además de la luz solar, otros factores predisponentes incluyen radiación ionizante, inflamación crónica con cicatrices, infecciones virales e inmunosupresión. Los pacientes con trasplante de órganos tienen un riesgo notablemente mayor, tal vez 200 veces, de desarrollar CCE, debido a su terapia inmunosupresora (1). Lo mismo es cierto para los pacientes con inmunodeficiencia debido a otros factores, por ejemplo, aquellos con infección por VIH (1, 2).
REPORTE DE UN CASO
Un hombre de 50 años presentó un gran tumor en la mejilla izquierda, que se había desarrollado en los últimos 3 meses. El tumor tenía un borde elevado y una úlcera central perforada. Había viajado a Túnez 6 meses antes con mucha exposición al sol. Aunque tenía piel Fitzpatrick tipo II, nunca había practicado la protección solar. El examen clínico no reveló más signos de daño actínico; específicamente, no tenía queratosis actínica. Desde su estancia en Túnez, el paciente también tenía tos seca crónica. Sus ganglios linfáticos cervicales eran normales a la palpación y con ecografía. La tomografía por resonancia magnética no mostró infiltración de estructuras de tejidos blandos adyacentes. Debido al rápido crecimiento del tumor y su aspecto macroscópico, sospechamos un queratoacantoma. El examen histológico reveló un CCE bien diferenciado pero ulcerado. El análisis citométrico de flujo de células T periféricas reveló un desequilibrio, con solo 5 células CD4+ / CD3 + y 226 células CD8+ / CD3 + (cociente 0,02), lo que indica inmunodeficiencia y tal vez explica el rápido crecimiento del tumor. A pesar del amplio asesoramiento sobre una enfermedad inmunosupresora potencialmente subyacente, el paciente rechazó otros procedimientos de diagnóstico del VIH, así como estudios adicionales para aclarar la tos (sospecha de neumonía por Pneumocystis jiroveci) y excluir metástasis. También rechazó una nueva escisión con márgenes más amplios y abandonó el hospital en contra del consejo médico.

Fig. 1. La mejilla izquierda de un hombre de 50 años con un gran tumor. a) Cara dorsal y b) cara lateral.
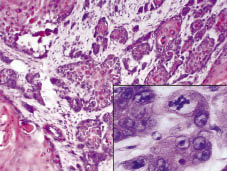
Fig. 2. La investigación histológica reveló un tumor infiltrante profundo, destruyendo las estructuras anatómicas de la lesión. Inserto: El tumor está compuesto por queratinocitos polimorfos con varias mitosis (H& E ×200, con aumento digital).
DISCUSIÓN
El queratoacantoma (KA) fue descrito por primera vez en 1889 por Jonathan Hutchinson como úlcera crateriforme de la cara. Se presenta con mayor frecuencia como un tumor cutáneo de rápido crecimiento en zonas expuestas al sol (3). Los hombres se ven afectados aproximadamente 3 veces más a menudo que las mujeres. La distribución ajustada por edad muestra que es más frecuente en la mediana edad y no aumenta la incidencia en personas de edad avanzada (a diferencia del carcinoma basocelular y el CCE) (4). Mientras que el CCE se desarrolla a partir del epitelio superficial, los KAs se derivan de la pared del folículo piloso justo por encima de donde entra el conducto sebáceo. Son una entidad distinta con características clínicas e histológicas específicas (5). La tendencia a la regresión espontánea y el amplio grado de queratinización son las características más llamativas, junto con la arquitectura simétrica típica del tumor (6).
La nosología exacta y la clasificación de KA son un tema de debate. Algunos autores consideran el KA como un tumor cutáneo benigno que es el prototipo de los tumores» pseudomalignos » de la piel, mientras que otros sostienen que es neoplasia maligna – una variante peculiar del CCE – y, por lo tanto, debe tratarse como el CCE (7-9). Las dificultades de diagnóstico son especialmente ciertas para las variantes destructivas y persistentes del KA, como el KA gigante o el KA mutilante. Clínicamente, el KA se diferencia del SCC por su historia de rápido crecimiento y su forma similar a un volcán. Sin embargo, en el caso descrito aquí, un CCE grande también mostró un crecimiento muy rápido, posiblemente debido a la infección por VIH. A veces, las lesiones consideradas como SCA deben reclasificarse como CCE en función de su evolución clínica posterior. Además de un diagnóstico erróneo, otras explicaciones son la combinación de KA y CCE, así como la transformación de KA en CCE. Además, algunos KAS pueden ser variantes bien diferenciadas de CCSC, como propuso Ackerman (10-12).
Debido a las dificultades para distinguir entre KA y CCE, el tratamiento de elección para todos los tipos de KAs sigue siendo la escisión quirúrgica con verificación histopatológica del diagnóstico (8-10). Si la cirugía es imposible, se puede considerar la radiación ionizante. Se ha notificado que varias otras opciones terapéuticas, como el 5-fluorouracilo tópico, las inyecciones intralesionales de interferón alfa, metotrexato o bleomicina y los retinoides administrados sistémicamente, son eficaces en casos individuales, pero no hay ensayos clínicos controlados que demuestren la eficacia de estos tratamientos (1, 4, 5).
Algunos CCE pueden crecer rápidamente, imitando un KA, como en el caso descrito aquí. La razón del rápido crecimiento de KAs no está clara; se han ofrecido varias hipótesis, incluida la inmunosupresión y la exposición a la luz solar excesiva. Los SK, especialmente los que no se pueden distinguir claramente del CCE, se deben tratar mediante escisión quirúrgica amplia, ya que pueden tener un pronóstico desfavorable con la aparición temprana de metástasis.
1. Sterry W, Stockfleth E. Tumor Maligno epitelial. En: Braun-Falco O, Plewig G, Wolff HH, Burgdorf WH, Landthaler M, editores. Dermatología y Venerología. 5th edn. Heidelberg: Springer, 2005: p. 1267-1276.
2. Nguyen P, Vin-Christian K, Ming ME, Berger T. Carcinomas de células escamosas agresivos en personas infectadas con el virus de inmunodeficiencia humana. Arch Dermatol 2002; 138: 758–763.
3. Rinker MH, Fenske NA, Scalf LA, Glass LF. Variantes histológicas del carcinoma de células escamosas de piel. Cancer Control 2001; 8: 354-363.
4. Mac Kie RM, Quinn AG. Cáncer de piel no melanoma y tumores de piel epidérmica. En: Burns T, Breathnack S, Cox N, Griffiths C, editores. Libro de dermatología de Rook. 7th edn. Massachusetts: Blackwell Science, 2004: p. 43-46.
5. Kurschat P, Hess S, Hunzelmann N, Scharffetter-Kochanek K. Keratoacanthoma centrifugum marginatum acompañado de una extensa reacción de cuerpo extraño granulomatoso. Dermatol Online J 2005; 11: 16.
6. Bayer-Garner IB, Ivan D, Schwartz MR, Tschen JA. Inmunopatología de regresión en queratosis liquenoide benigna, queratoacantoma y halo nevo. Clin Med Res 2004; 2: 89-97.
7. Cribier B, Asch P, Grosshans E. Diferenciación del carcinoma de células escamosas del queratoacantoma mediante criterios histopatológicos. Es posible? Un estudio de 296 casos. Dermatology 1999; 199: 208-212.
8. Beham A, Regauer S, Soyer HP, Beham-Schmid C. Queratoacantoma: una variante clínicamente distinta del carcinoma de células escamosas bien diferenciado. Adv Anat Pathol 199; 5: 269-280.
9. Warner DM, Flowers F, Ramos-Caro FA. Queratoacantoma solitario( carcinoma de células escamosas): manejo quirúrgico. Int J Dermatol 1995; 34: 17-19.
10. Hodak E, Jones RE, Ackerman AB. El queratoacantoma solitario es un carcinoma de células escamosas: tres ejemplos con metástasis. Am J Dermatopathol 1993; 15: 332-342.
11. Sanchez YE, Simon P, Requena L, Ambrojo P, de Eusebio E. Queratoacantoma solitario: una proliferación auto-curativa que con frecuencia se vuelve maligna. Am J Dermatopathol 2000; 22: 305-310.
12. Lawrence N, Reed RJ. Queratoacantoma actínico. Especulaciones sobre la naturaleza de la lesión y el papel de la inmunidad celular en su evolución. Am J Dermatopathol 1990; 12: 517-533.