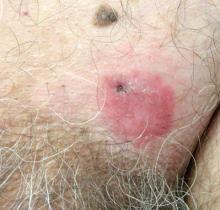
Un hombre de 70 años de edad presentó una placa escamosa eritematosa no pruriginosa en la región suprapúbica izquierda de 6 meses de duración que no había respondido a la crema de terbinafina al 1% después de 1 mes de tratamiento de la sospecha de tiña cruris. Su historial médico fue notable por hipertensión, hiperlipidemia, enfermedad pulmonar obstructiva crónica, hiperplasia prostática benigna, aneurisma aórtico abdominal, dependencia del alcohol, trastorno por consumo de tabaco y pérdida de peso involuntaria de 15 libras en el último año.
El diagnóstico: Enfermedad de Paget Extramamaria
Una biopsia de la placa reveló una proliferación intraepidérmica de células grandes con abundante citoplasma claro y grandes núcleos vesiculares distribuidos por toda la epidermis (Figura 1). Las células neoplásicas se tiñeron de positivo para tinción periódica de ácido–Schiff (Figura 2) y CK7 (Figura 3). El panel químico y de función hepática, el análisis de orina, los niveles de antígeno carcinoembrionario y los niveles de antígeno prostático específico se encontraban dentro del rango de referencia. Un recuento completo de células sanguíneas reveló anemia megaloblástica leve. La tomografía computarizada posterior de tórax, abdomen y pelvis reveló un aneurisma aórtico abdominal y agrandamiento de la próstata sin evidencia de posibles neoplasias malignas. La colonoscopia reveló múltiples pólipos hiperplásicos y un adenoma tubular. La cistoscopia fue normal, excepto por evidencia de agrandamiento de la próstata. La citología de orina no fue notable. Se derivó a la paciente para la escisión de la lesión con cirugía micrográfica de Mohs. Se recomendó un seguimiento cada 3 meses durante los primeros 2 años después de la cirugía y cada 6 meses a partir de entonces para vigilar la recidiva o neoplasias secundarias.
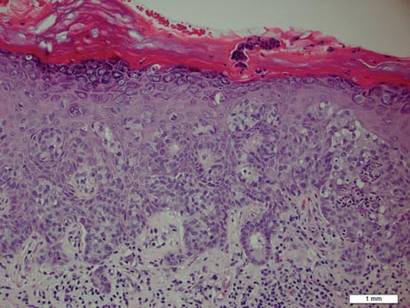
Figura 1. Proliferación intraepidérmica de células grandes con abundante citoplasma claro y núcleos vesiculares grandes distribuidos por toda la epidermis como células individuales y como agregados de células de tamaño variable (H&E, aumento original ×200). (Referencia de la barra indica 1 mm.)
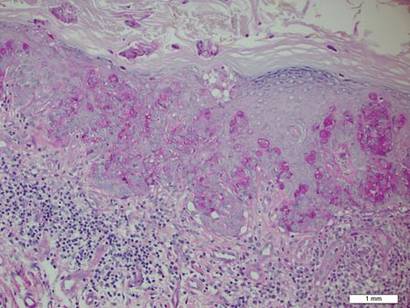
Figura 2. El citoplasma granular fue positivo en la tinción periódica de ácido-Schiff (aumento original ×200). (Referencia de la barra indica 1 mm.)
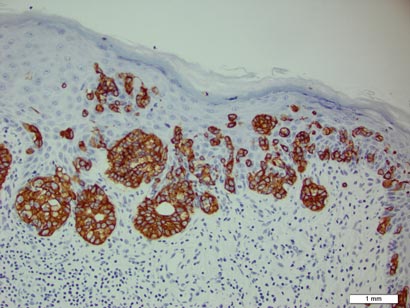
Figura 3. Las células neoplásicas de Paget fueron característicamente positivas en la tinción para CK7 (aumento original ×200). (La barra de referencia indica 1 mm.)
Sir James Paget describió por primera vez la enfermedad mamaria de Paget del pezón en 1874 en su informe de 15 mujeres con erupciones cutáneas del pezón y la areola y carcinoma posterior de la mama subyacente.1 Paget también describió a un paciente con una erupción similar en el glande del pene y Crocker2 describió la enfermedad extramamaria de Paget (EMPD) del escroto y el pene en 1889. La principal diferencia entre la enfermedad mamaria de Paget y la EMPD es la localización anatómica.
La enfermedad extramamaria de Paget es una afección poco frecuente que afecta típicamente a pacientes de 50 a 80 años de edad y es más común en mujeres y razas de piel blanca.3 La enfermedad de Paget extramamaria se dirige con frecuencia a sitios cutáneos ricos en glándulas apocrinas. El sitio más comúnmente afectado es la vulva, seguida de la piel perineal, perianal, escrotal y del pene. Con menos frecuencia, las axilas, las nalgas, los muslos, los párpados y los canales auditivos externos pueden verse afectados.4
Los pacientes con DME suelen presentar placas eritematosas y eccematosas bien delimitadas, sin solución, que pueden tener costras, descamación, excrecencias papilomatosas, liquenificación, ulceración o sangrado asociados. El síntoma más común es el prurito, seguido de ardor, irritación, dolor y sensibilidad.5 El diez por ciento de los pacientes son asintomáticos. El intervalo promedio entre el inicio de los síntomas y el diagnóstico es de 2 años.5
La histopatología revela células de Paget neoplásicas irregulares, difusamente infiltrantes dentro de la epidermis que son grandes y vacuoladas con abundante citoplasma azulado pálido y núcleos vesiculares grandes, que pueden comprimirse central o lateralmente. Las células pueden distribuirse individualmente o en grupos como hebras, nidos o patrones glandulares dentro de la epidermis inferior, crestas de retes y estructuras anexas. Hiperqueratosis, acantosis y paraqueratosis también pueden estar presentes. Tinción de células Paget para marcadores inmunohistoquímicos de derivación apocrina y ecrina, incluidas citoqueratinas de bajo peso molecular, proteína líquida de enfermedad quística macroscópica 15, tinción de ácido periódico de Schiff y antígeno carcinoembrionario.5 Perrotto et al6 estudiaron 98 muestras de 61 pacientes y encontraron que la CK7 fue positiva en todas las muestras de EMPD, mientras que la CK20 y la proteína líquida de enfermedad quística macroscópica 15 fueron positivas en subgrupos grandes de EMPD primaria y secundaria. Los casos de EMPD secundarios a adenocarcinoma anorrectal fueron en gran medida ERBB2 (anteriormente HER2/neu) negativos y CDX2 positivos.6
El diagnóstico de EMPD debe ir seguido de una investigación exhaustiva de carcinomas subyacentes. En una revisión de 197 casos de EMPD, 24% de los pacientes con EMPD tenían un carcinoma apocrino anexo invasivo o in situ subyacente relacionado, que se relacionó con una tasa de mortalidad más alta que en los pacientes sin esta neoplasia maligna subyacente. Además, el 12% de los pacientes con EMPD tenían una neoplasia maligna interna subyacente asociada.7 Estas neoplasias malignas pueden incluir carcinomas de uretra, vejiga, vagina, cuello uterino, endometrio, próstata, colon y recto. La EMPD perianal tiene una frecuencia más alta de neoplasias asociadas que la EMPD vulvar.5 La ubicación de la DME está relacionada con la ubicación de la neoplasia maligna subyacente; por ejemplo, la DME perianal se relaciona con adenocarcinomas colorrectales, y la DME del pene, el escroto y la ingle se relaciona con neoplasias malignas genitourinarias. Las investigaciones para buscar neoplasias malignas asociadas en pacientes con EMPD pueden incluir ecografía pélvica o imágenes por resonancia magnética, histeroscopia, colonoscopia, sigmoidoscopia, cistoscopia, pielograma intravenoso, mamografía o radiografía de tórax.