Dipole
Um die Natur nicht-kovalenter Wechselwirkungen zu verstehen, müssen wir zuerst zu kovalenten Bindungen zurückkehren und uns mit dem Thema Dipole befassen. Viele der kovalenten Bindungen, die wir gesehen haben – zum Beispiel zwischen zwei Kohlenstoffen oder zwischen einem Kohlenstoff und einem Wasserstoff – beinhalten die ungefähr gleiche Aufteilung der Elektronen zwischen den beiden Atomen in der Bindung. In diesen Beispielen haben die beiden Atome ungefähr die gleiche Elektronegativität. Erinnern Sie sich aus Ihrem allgemeinen Chemiekurs daran, dass sich Elektronegativität auf „die Kraft eines Atoms in einem Molekül bezieht, Elektronen an sich selbst anzuziehen“ (dies ist die Definition von Linus Pauling, dem bedeutenden amerikanischen Chemiker des 20.
In der organischen Chemie befassen wir uns jedoch häufig mit kovalenten Bindungen zwischen zwei Atomen mit unterschiedlichen Elektronegativitäten, und in diesen Fällen ist die Aufteilung der Elektronen nicht gleich: Der elektronegativere Kern zieht die beiden Elektronen näher zusammen. In der Kohlenstoff-Sauerstoff-Bindung eines Alkohols werden beispielsweise die beiden Elektronen in der Sigma-Bindung enger an den Sauerstoff als an den Kohlenstoff gehalten, da Sauerstoff deutlich elektronegativer ist als Kohlenstoff. Gleiches gilt für die Sauerstoff-Wasserstoff-Bindung, da Wasserstoff etwas weniger elektronegativ als Kohlenstoff und viel weniger elektronegativ als Sauerstoff ist.
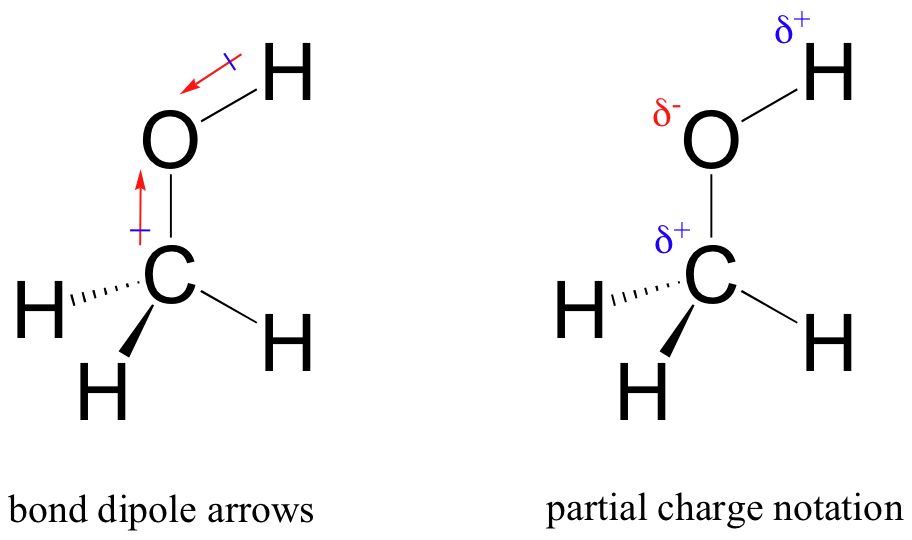
Das Ergebnis dieser ungleichen Aufteilung ist das, was wir einen Bindungsdipol nennen, der in einer polaren kovalenten Bindung existiert. Ein Bindungsdipol hat sowohl negative als auch positive Enden oder Pole, wobei die Elektronendichte niedriger (der positive Pol) und höher (der negative Pol) ist. Der Unterschied in der Elektronendichte kann mit dem griechischen Buchstaben Delta ausgedrückt werden, um die partielle positive und partielle negative Ladung der Atome zu bezeichnen. ‚Dipolpfeile‘, mit einem positiven Vorzeichen am Schwanz, werden auch verwendet, um die negative Richtung (höhere Elektronendichte) des Dipols anzuzeigen.
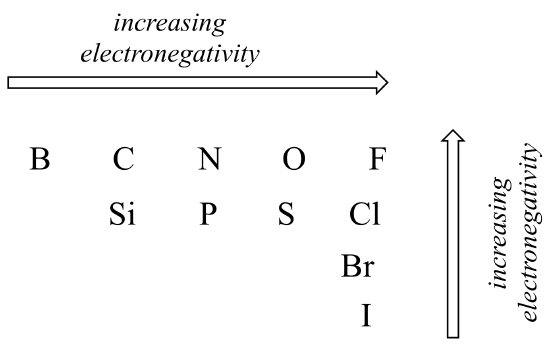
Der Grad der Polarität in einer kovalenten Bindung hängt von der Differenz der Elektronegativität zwischen den beiden Atomen ab. Die Elektronegativität ist ein periodischer Trend: Sie nimmt von links nach rechts über eine Zeile des Periodensystems der Elemente zu und nimmt auch zu, wenn wir eine Spalte nach oben bewegen. Daher ist Sauerstoff elektronegativer als Stickstoff, der wiederum elektronegativer als Kohlenstoff ist. Sauerstoff ist auch elektronegativer als Schwefel. Fluor, in der oberen rechten Ecke des Periodensystems, ist das elektronegativste der Elemente. Wasserstoff ist etwas weniger elektronegativ als Kohlenstoff.
Periodische Trends in der Elektronegativität
Übung 2.26
Rationalisieren Sie anhand dessen, was Sie über Atomorbitale wissen, die periodischen Trends in der Elektronegativität. Warum nimmt es von links nach rechts zu und von oben nach unten ab? Dies ist eine gute Frage, um mit Klassenkameraden und einem Lehrer oder Tutor zu sprechen.
Lösungen für Moleküle
Die meisten Moleküle enthalten sowohl polare als auch unpolare kovalente Bindungen. Abhängig von der Position der polaren Bindungen und der Bindungsgeometrie können Moleküle eine Nettopolarität besitzen, die als molekulares Dipolmoment bezeichnet wird. Wie Sie sich wahrscheinlich erinnern, hat Wasser ein Dipolmoment, das sich aus den kombinierten Dipolen seiner beiden Sauerstoff-Wasserstoff-Bindungen ergibt. Fluormethan hat auch ein Dipolmoment.
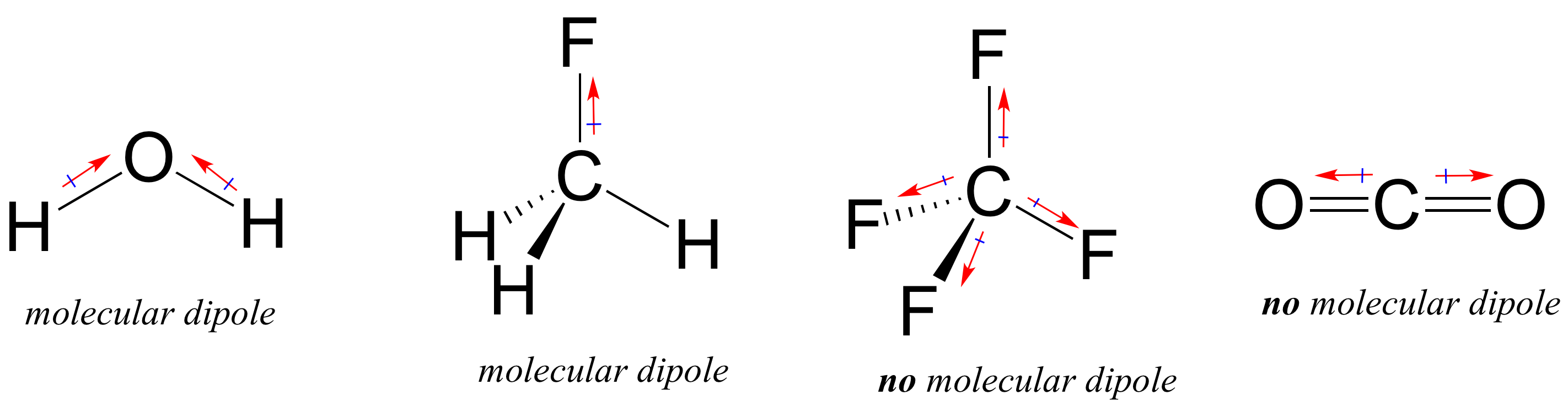
Tetrafluormethan hat jedoch vier polare Bindungen, die sich gleichmäßig in die vier Ecken eines Tetraeders ziehen, was bedeutet, dass es zwar vier Bindungsdipole gibt, aber kein molekulares Dipolmoment. Kohlendioxid fehlt auch ein molekulares Dipolmoment.
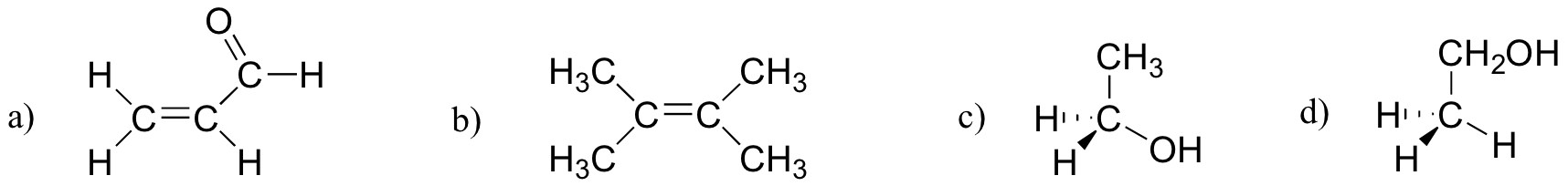
Aufgabe 2.27
Welche der folgenden Moleküle haben molekulare Dipolmomente?
Lösungen für Übungen