Fakten, Zusammenfassung & Definition
- Ein Addukt ist ein Produkt, das durch eine Additionsreaktion gebildet wird
- Addukte können nur aus Reaktanten gebildet werden, die Mehrfachbindungen aufweisen, wie Alkene und Carbonylgruppen
- Addukte können durch zwei Arten von Additionsreaktionen gebildet werden: elektrophile und nukleophile
- Addukte bilden sich häufig zwischen Lewis-Säuren und Lewis-Basen
Was ist ein Addukt?
Ein Addukt ist ein Produkt, das am Ende einer Additionsreaktion entsteht. Dies ist eine Reaktion, bei der zwei oder mehr Moleküle reagieren und sich zu einem größeren Produkt verbinden. Diese Art der Reaktion kann nur zwischen chemischen Verbindungen auftreten, die Mehrfachbindungen aufweisen – Verbindungen wie Alkene (Doppelbindungen) und Alkine (Dreifachbindungen). Carbonyl- (C=O) und Imin- (C=N) Gruppen können ebenfalls Additionsreaktionen eingehen und so Addukte bilden.
Wie entstehen Addukte?
Wie bereits erwähnt, entstehen Addukte durch Additionsreaktionen. Bei dieser Art von Reaktion bricht die Doppelbindung teilweise, wenn ein reagierendes Molekül angreift und addiert. Die folgende Reaktion zeigt eine Additionsreaktion zwischen Ethen und Brom.

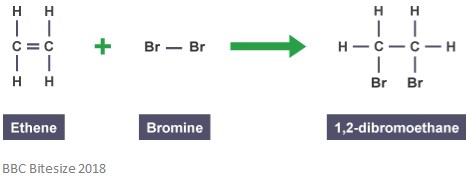
Das Addukt in dieser Reaktion ist 1,2-Dibromethan. Dies liegt daran, dass es sich um eine eigenständige Spezies handelt, die alle Atome aller Komponenten enthält.
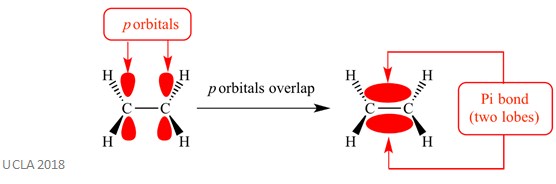
Diese Additionsreaktionen beinhalten normalerweise pi (π) -Bindungen. Dies ist eine komplexe Art von Bindung, bei der sich die p–Orbitale benachbarter Atome überlappen – diese Überlappung verursacht die pi-Bindung. Dies geschieht senkrecht zu allen Sigma-Bindungen zwischen diesen beiden gleichen Atomen. Diese Pi-Bindung hat auch zwei Orbitallappen – einer befindet sich oberhalb der Ebene der Sigma-Bindung und der andere unterhalb der Ebene der Sigma-Bindung. Die Pi-Bindung ist in der folgenden Abbildung dargestellt.

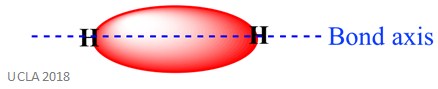
Die gleiche Reaktion kann auch Sigma (σ) -Bindungen beinhalten. Dies ist eine Art kovalente Bindungsform durch Überlappung von Atomorbitalen entlang der Bindungsachse – mit anderen Worten entlang der Linie, die die beiden gebundenen Atome verbindet. Zum Beispiel wird die Sigma-Bindung in einem Wasserstoffatom durch die Überlappung von zwei 1s–Orbitalen gebildet – eines von jedem Wasserstoffatom. Dies ist besser im Bild unten zu sehen – der rote Bereich zeigt die Sigma-Bindung.

Es gibt zwei Haupttypen von Additionsreaktionen: elektrophile Addition und nukleophile Addition.
Elektrophile Addition
Eine elektrophile Additionsreaktion ist eine Art von Reaktion, bei der eine Bindung aufgebrochen wird und zwei neue Bindungen gebildet werden. Wie bereits erwähnt, muss der Reaktant eine Doppel– oder Dreifachbindung aufweisen – das Elektrophile addiert sich in diesem Fall zu einer Pi-Bindung. Dies ist eine Additionsreaktion, und so geht dabei nichts verloren – alle Atome, die sich in den Reaktionsmolekülen befinden, befinden sich auch im Addukt.

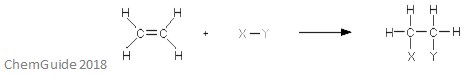
Das obige Bild zeigt den Ablauf einer elektrophilen Additionsreaktion. Wie Sie sehen können, befinden sich alle Atome in den Reaktanten im Addukt.
Nukleophile Addition
Eine nukleophile Additionsreaktion ist eine Art von Reaktion, bei der eine Doppelbindung gebrochen wird und zwei Einfachbindungen gebildet werden. Eine elektronenarme (elektrophile) Doppel- oder Dreifachbindung reagiert mit etwas Elektronenreichem (nukleophil). Das Nucleophil addiert sich in diesem Fall zu einer Pi-Bindung. Ein Beispiel für eine nukleophile Additionsreaktion ist unten gezeigt.

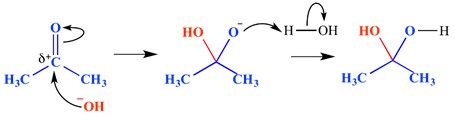
In diesem Beispiel hat sich am delta–positiven Ende der Carbonylgruppe ein Hydroxidion anlagert – dies hat ein oxyanionisches tetraedrisches Zwischenmolekül gebildet. Das Endergebnis ist daher die Zugabe von Wasser über die Carbonylgruppe pi-Bindung.
Lewis-Säuren und Lewis-Basen
Es ist oft bekannt, dass sich Addukte zwischen Lewis-Säuren und Lewis-Basen bilden. Das gebildete Molekül wird als Lewis-Säure-Base-Addukt (oder Lewis-Säure-Base-Komplex) bezeichnet. Da Addukte nur durch Additionsreaktionen (d. h. ohne gleichzeitigen Verlust einer Gruppe) gebildet werden, können Lewis-Säure- und Lewis-Base-Reaktionen nicht die der Substitutionsart sein.
Ein gutes Beispiel dafür ist die Reaktion zwischen THF und BH3, die im Bild unten gezeigt wird. Wie Sie sehen werden, sind diese Lewis-Säure-Lewis-Base-Addukte mit Punkten dargestellt – diese repräsentieren Elektronen.

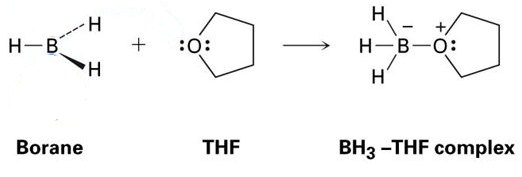
Wie Sie sehen können, ist das einzige gebildete Produkt der BH3-THF-Komplex, was bedeutet, dass es sich um ein Addukt handelt.
Diese Arten von Reaktionen können auch mit Pfeilen dargestellt werden – diese Pfeile stellen die Spende von Elektronen von der Base zur Säure dar. Die gleiche Reaktion ist unten gezeigt, jedoch mit Pfeilen zur Anzeige der Elektronendonation.

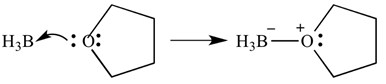
Es ist wichtig zu beachten, dass diese Pfeile zwei „Widerhaken“ am spitzen Ende haben. Dies zeigt an, dass ein Elektronenpaar gespendet wurde. Wenn nur ein Elektron gespendet wird, hat der Pfeil nur einen Barden am spitzen Ende.
In diesem Fall ist die Lewis-Säure Boran und die Lewis-Base ist THF. Wie Sie sehen können, hat die Base der Säure ein einzelnes Elektronenpaar gespendet, um eine Sauerstoff-Bor-Bindung zu bilden.
Verbindungen, die aufgrund der Form der Moleküle keine Addukte bilden können, werden als frustrierte Lewis-Paare bezeichnet.
Weiterführende Literatur
http://www.chem.ucla.edu/~harding/IGOC/L/lewis_acid_base_adduct.html