VIVO Pathophysiologie
Weitere Themen
Aquaporine: Wasserkanäle
Wasser durchquert Zellmembranen auf zwei Wegen: durch Diffusion durch die Lipiddoppelschicht und durch Wasserkanäle, die Aquaporine genannt werden. Die funktionelle Charakterisierung des ersten Aquaporins wurde 1992 berichtet, aber Wasserkanäle wurden lange vor dieser Zeit vermutet, da die osmotische Permeabilität einiger Arten von Epithelzellen viel zu groß war, um durch einfache Diffusion durch die Plasmamembran erklärt zu werden.
Ein einziger menschlicher Aquaporin-1-Kanal ermöglicht den Wassertransport mit einer Geschwindigkeit von etwa 3 Milliarden Wassermolekülen pro Sekunde. Ein solcher Transport scheint entsprechend dem vorherrschenden osmotischen Gradienten bidirektional zu sein.
Die klassischen Aquaporine transportieren gelöstes Wasser über Zellmembranen; sie scheinen exklusive Wasserkanäle zu sein und durchdringen Membranen nicht zu Ionen oder anderen kleinen Molekülen. Einige Aquaporine – bekannt als Aquaglyceroporine – transportieren Wasser plus Glycerin und einige andere kleine Moleküle.
Die Aquaporin-Familie
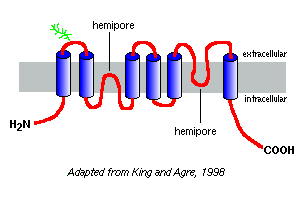
Bisher wurden mehr als 10 verschiedene Säugetier-Aquaporine identifiziert, und es wird vermutet, dass weitere Mitglieder existieren. Eng verwandte Wasserkanalproteine wurden aus Pflanzen, Insekten und Bakterien isoliert. Aquaporin-1 aus menschlichen roten Blutkörperchen wurde als erstes entdeckt und ist wahrscheinlich das am besten untersuchte.
Hydrophobizitätsdiagramme ihrer Aminosäuresequenzen sagen voraus, dass die Aquaporine sechs membranspannende Segmente haben, wie im Modell von Aquaporin-1 rechts dargestellt.
Basierend auf Studien mit Aquaporin-1 scheint es, dass Aquaporine in der Plasmamembran als Homotetramere existieren. Jedes Aquaporin-Monomer enthält zwei Halbporen, die sich zu einem Wasserkanal zusammenfalten.
Verschiedene Aquaporine haben unterschiedliche Glykosylierungsmuster. Im Fall von Aquaporin-1 beträgt das Peptidrückgrat etwa 28 kDa und die glykosylierten Formen reichen von 40 bis 60 kDa in der Masse. Die meisten Aquaporine haben ein Proteinkinase-A-Phosphorylierungsmotiv in einer der zytoplasmatischen Schleifen, und differentielle Phosphorylierung wird vermutet, dass sie dem Molekül eine regulatorische Funktion verleihen.
Muster der Aquaporin-Expression
Jedes der Aquaporine hat ein im Wesentlichen einzigartiges Expressionsmuster im Gewebe und während der Entwicklung. Eine Zusammenfassung dieser Attribute und einiger wichtiger potenzieller oder bekannter Funktionen ist in der folgenden Tabelle dargestellt:
| Wichtige Expressionsstellen | |||||
|---|---|---|---|---|---|
| Aquaporin-0 | Auge: Linsenfaserzellen | Flüssigkeitshaushalt innerhalb der Linse | |||
| Aquaporin-1 | Rote Blutkörperchen | Osmotischer Schutz | |||
| Niere: proximal tubule | Concentration of urine | Eye: ciliary epithelium | Production of aqueous humor | Brain: choriod plexus | Production of cerebrospinal fluid | Lung: alveolar epithelial cells | Alveolar hydration state |
| Aquaporin-2 | Kidney: collecting ducts | Mediates antidiuretic hormone activity | |||
| Aquaporin-3 * | Kidney: collecting ducts | Reabsorbtion of water into blood | |||
| Trachea: epithelzellen | Sekretion von Wasser in die Luftröhre | ||||
| Aquaporin-4 | Niere: Sammelkanäle | Reabsorption von Wasser | |||
| Gehirn: Ependymzellen | Liquor-Flüssigkeitshaushalt | ||||
| Gehirn: Hypothalamus | Osmosensing funktion? | ||||
| Lunge: bronchialepithel | Bronchialflüssigkeitssekretion | ||||
| Aquaporin-5 | Speicheldrüsen | Speichelproduktion | |||
| Tränendrüsen | |||||
| Aquaporin-6 | Niere | Sehr geringe Wasseraufnahme | urchlässigkeit; Funktion? | ||
| Aquaporin-7 * | Fettzellen | Transportiert Glycerin aus Adipozyten | |||
| Hoden und Sperma | |||||
| Aquaporin-8 | Hoden, Bauchspeicheldrüse, Leber, andere | ||||
| Aquaporin-9 * | Leukozyten | ||||
| * ein Aquaglyceroporin | |||||
Es sollte klar sein, dass Aquaporine sehr weit verbreitet sind und auch, dass die verschiedenen Aquaporine unterschiedliche funktionell wichtige Spezialitäten.
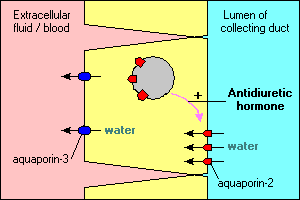
Einige interessante und wichtige Merkmale des Aquaporin-vermittelten Wassertransports werden in den Hauptzellen dargestellt, die die Sammelkanäle in der Niere auskleiden. Wasser, das durch diese Kanäle fließt, kann entweder weitergehen und im Urin ausgeschieden werden oder über das Epithel und zurück ins Blut resorbiert werden. Die Reabsorption ist im Wesentlichen gleich Null, es sei denn, die Epithelzellen sehen ein antidiuretisches Hormon, das die Reabsorption von Wasser stark stimuliert. Sammelkanalzellen exprimieren mindestens zwei Aquaporine:
- Aquaporin-2 wird synthetisiert, befindet sich jedoch in Abwesenheit des antidiuretischen Hormons in einem Pool von Membranvesikeln im Zytoplasma. Die Bindung des antidiuretischen Hormons an seinen Rezeptor in der Zelle stimuliert nicht nur die Transkription des Aquaporin-2-Gens, sondern bewirkt auch, dass der intrazelluläre Pool von Aquaporin-2 in die apikale Membran eingeführt wird. Die Zelle kann nun effizient Wasser aus dem Lumen des Kanals aufnehmen.
- Aquaporin-3 wird konstitutiv in der basolateralen Membran der Zelle exprimiert. Wenn Wasser durch Aquaporin-2-Kanäle in die Zelle strömt, kann es die Zelle durch die Aquaporin-3-Kanäle schnell verlassen und in Blut fließen.
Aquaporine und Krankheiten
In Anbetracht der Bedeutung des Wassertransports in einer Vielzahl von physiologischen Prozessen ist zu erwarten, dass Läsionen in Aquaporin-Genen oder erworbene Funktionsstörungen in Aquaporinen mehrere Krankheitszustände verursachen oder dazu beitragen können. Die Suche nach solchen Verbindungen ist noch früh, Es wurden jedoch zwei klare Beispiele für Krankheiten identifiziert, die auf einen Mangel an Aquaporinen zurückzuführen sind:
- Mutationen im Aquaporin-2-Gen verursachen beim Menschen erblichen nephrogenen Diabetes insipidus.
- Mäuse, die homozygot sind, um Mutationen im Aquaporin-0-Gen zu inaktivieren, entwickeln angeborene Katarakte.
- Adipositas im Erwachsenenalter entwickelt sich bei Mäusen, die homozygot sind, um Mutationen im Aquaporin-7-Gen zu inaktivieren, vermutlich aufgrund der Ineffizienz beim Transport von Glycerin aus hydrolysierten Triglyceridspeichern.
Eine kleine Anzahl von Menschen wurde mit schwerem oder totalem Mangel an Aquaporin-1 identifiziert. Interessanterweise scheinen sie klinisch nicht betroffen zu sein, wurden jedoch nicht unter Bedingungen des Wassermangels untersucht. Mäuse mit gezielten Deletionen in Aquaporin-1 erscheinen auch normal und gesund, es sei denn, sie sind flüssigkeitsbeschränkt, In diesem Fall werden sie stark hyperosmolar.
Referenzen und Rezensionen
- Borgnia M, Nielsen S, Engel A, Agre P: Zell- und Molekularbiologie von Aquaporin-Wasserkanälen. Annu Rev Biochem 68:425, 1999.DeGroot BL, Grubmüller H: Wasserpermeation durch biologische Membranen: Mechanismus und Dynamik von Aquaporin-1 und GlpF. Wissenschaft 294:2353, 2001.Hibuse T, Proc Nat Acad Sci (USA) 102:10993, 2005.
- König LS, Agre P: Pathophysiologie der Aquaporin Wasserkanäle. Annu Rev Physiol 58:619, 1998.
- Knepper MA, Inoue T: Regulation des Aquaporin-2-Wasserkanalhandels durch Vasopressin. Curr Meinung Zelle Biol 9:560, 1997.
- Lee MD, King LS, Agre P: Die Aquaporin-Familie von Wasserkanalproteinen in der klinischen Medizin. Medizin 76: 141, 1997.Preston GM, Carroll TP, Guggino WP Agre P: Auftreten von Wasserkanälen in Xenopus-Oozyten, die Erythrozyten-CHIP28-Protein exprimieren. Wissenschaft 256: 385, 1992.
- Sasaki S, Ishibashi K, Marumo F: Aquaporin-2 und -3: Vertreter zweier Untergruppen der Aquaporin-Familie, die im Nierensammelgang kolokalisiert sind. Annu Rev Physiol 60:199, 1998.