Biomaterialien
Es ist möglich, das Studium von Biomaterialien durch eine sehr allgemeine, aber kohärente Definition von Parks und Seen abzugrenzen . Demnach kann ein Biomaterial als jedes Material definiert werden, das bei der Herstellung von Vorrichtungen verwendet wird, um einen Teil oder eine Funktion des Körpers auf sichere, zuverlässige, wirtschaftliche und physiologisch akzeptable Weise zu ersetzen.
Um die Funktion des Ersetzens, Vergrößerns oder Stützens einer Struktur zufriedenstellend zu erfüllen, muss das Implantat die Eigenschaften des Gewebes nachahmen oder anpassen. Die Literatur berichtet über die Existenz verschiedener Arten von Knochentransplantaten, die in Implantaten verwendet werden: autolog (abgeleitet von demselben Individuum); homolog (von einem Individuum derselben Spezies des Empfängers); und heterolog (wenn die Spezies des Spenders und des Empfängers nicht gleich sind – zum Beispiel Rinder ).
Autologe Transplantate haben bestimmte Nachteile, zum Beispiel: intervention in einem gesunden Bereich des Körpers des Patienten; Morbidität des Spenderbereichs, höhere Erholungsphase; Anfälligkeit für Infektionen; und fortschreitende und konstante Resorption . So wurden Implantate in synthetischen Biomaterialien wie Keramik und Polymeren weit verbreitet entwickelt und angewendet. Laut Pereira, Buono und Zavaglia ist die Nachfrage nach Biomaterialien jedes Jahr von 5 auf 15% gestiegen.
Klassifizierung von Biomaterialien
Nach Bath und Santos können Biomaterialien entsprechend ihrer Kompatibilität mit dem umgebenden Gewebe in vier Klassen eingeteilt werden:
Biotolerant: Implantat, das durch eine Weichgewebsschicht über der Grenzfläche vom umgebenden Knochen getrennt ist. Kein Kontakt in der Osteogenese. Die Schicht wird durch die Implantatfreisetzung von Monomeren, Ionen und/oder Korrosionsprodukten induziert. Fast alle synthetischen Polymere und die meisten Metalle gehören zu dieser Kategorie.
Bioinert: Implantate in direktem Kontakt mit Knochengewebe, auftretende Beteiligung an der Osteogenese. Es findet jedoch keine chemische Reaktion zwischen dem Gewebe und dem Implantat statt. Es gibt nicht, zumindest in Mengen, die von Zellen nachweisbar sind, die Freisetzung einer Komponente. Beispiele für bioinerte Biomaterialien sind: Aluminiumoxid, Zirkonoxid, Titan, Tantal, Niob und Kohlenstoff.
Bioaktiv: Es gibt die Wechselwirkung zwischen dem Implantat und dem Knochengewebe, die direkt in die Osteogenese eingreift. Durch chemische Ähnlichkeit bindet der mineralische Teil des Knochengewebes an das Implantat und fördert die Osteokonduktion. Die Hauptmaterialien dieser Klasse sind: Ca-Phosphat, Vitro-Keramik und Hydroxylapatit.
Bioresorbierbar: Materialien, die nach einer gewissen Zeit in Kontakt mit den Geweben vom Körper abgebaut, solubilisiert oder phagozytiert werden. Sie sind von Interesse in klinischen Anwendungen, bei denen es nicht ratsam ist, das Implantat erneut zu entfernen. Vertreter dieser Klasse sind Tricalciumphosphat (TCP) und PLLA (Poly-L-Milchsäure).
Metallische Biomaterialien
Manchmal werden metallische Elemente in ihrer natürlichen Form und in geringen Mengen vom Körper toleriert, wie Eisen (Fe) in roten Blutkörperchen, Kobalt (Co) bei der Synthese von Vitamin B12 und in den Querverbindungen des in der Aortenarterie vorhandenen Elastins . In großen Mengen werden die meisten Metalle jedoch vom Körper nicht vertragen.
Einige Metalle werden aufgrund ihrer hervorragenden mechanischen Eigenschaften und Korrosionsbeständigkeit als Ersatz für Hartgewebe verwendet, beispielsweise für Hüft- und Kniegelenkersatz, Platten und Schrauben zur Fixierung von Frakturen, Säulenfixierungsvorrichtungen und Zahnimplantaten . Laut Barbucci sollte ein Metallmaterial, das bei der Konstruktion von orthopädischen Prothesen, Osteosynthesegeräten und Zahnimplantaten verwendet wird, die folgenden Eigenschaften aufweisen:
- Grenzwiderstand gleich oder größer als 800 MPa;
- Korrosionsbeständigkeit (lokal und allgemein);
- Biokompatibilität.
Biokompatibilität ist kein Effekt oder ein einzigartiges Phänomen. Es bezieht sich auf eine Reihe von Prozessen mit unterschiedlichen Interaktionsmechanismen, die jedoch in Bezug auf Materialien und Gewebe voneinander abhängig sind. Es ist die Fähigkeit des Materials, eine bestimmte Funktion im Körper auszuführen, ohne toxische oder schädliche Auswirkungen auf die biologischen Systeme zu verursachen .
Diese Eigenschaften sind so restriktiv, dass nur wenige Klassen metallischer Werkstoffe erfolgreich eingesetzt werden können.
Die erste Legierung, die speziell für den Einsatz im menschlichen Körper entwickelt wurde, war der „Vanadiumstahl“, der zur Herstellung von Platten und Schrauben für Knochenbrüche verwendet wurde . Unter den metallischen Biomaterialien werden am häufigsten austenitische Edelstähle vom Typ 316 LVM, Legierungen Co-Cr-Mo, Co-Ni-Cr-Mo, Reintitan und Ti-6Al-4V verwendet . Einige Beispiele sind in Abbildung 1 dargestellt.

Abbildung 1: Metallische Geräte der medizinischen Anwendung: a) Femurkopf; b) Knie der oberen Artikulation; c) Unterkiefergelenkplatte.
In dieser Arbeit werden wir uns genauer mit Legierungen Co und Ti befassen, deren Anwendung im DMLS Rapid Prototyping im medizinischen Bereich ausdrucksvoller ist.
Kobaltlegierungen
Kobaltlegierungen wurden ursprünglich vor mehr als 70 Jahren für chirurgische Implantate vorgeschlagen . Es gibt grundsätzlich zwei Arten von Co-Legierungen für medizinische Anwendungen. Die Legierung Co-Cr-Mo für die Beschichtung und die bearbeiteten Legierungen Co-Ni-Cr-Mo . Die American Society for Testing and Materials (ASTM) listet vier Co-Legierungen auf, die für den Einsatz in chirurgischen Implantaten empfohlen werden: Coating Alloy Co-Cr-Mo (F75) und Coating alloys Co-Cr-W-Ni (F90), Co-Ni-Cr-Mo (F562) und Co-Cr-Mo (F1537).
Diese Legierungen sind eine Klasse von Materialien, die in physiologischen Umgebungen sehr korrosionsbeständig und verschleißfest sind und den Edelstahl übertreffen . Darüber hinaus ermöglichen seine überlegene Widerstandsgrenze und Ermüdungsfestigkeit seine Anwendung, wo eine lange Lebensdauer ohne das Auftreten von Brüchen oder Stress / Ermüdung erforderlich ist. Viele eigenschaften sind entstanden aus der kristallographischen natur von kobalt, die booster wirkung von Cr und Mo, und die carbide bildung von hoher härte.
Solche besonderen Eigenschaften haben zur Verwendung dieser Legierungen in verschiedenen medizinischen Anwendungen geführt, insbesondere in solchen, die darauf abzielen, die Gelenkflächen zu ersetzen. Ihre Eigenschaften Verschleißfestigkeit, Korrosion und niedriger Reibungskoeffizient sind ausschlaggebend für diese Wahl.
Ein Anwendungsbeispiel ist die Totale Hüftendoprothetik (THA). Die neueren Systeme bestehen aus einem Femurstab, der an einem modularen Kopf befestigt ist, der mit der acetabulären Komponente koordiniert ist . Dieses System ist als MoM (Metall auf Metall) bekannt – in Bezug auf die Kontaktfläche – und ist besser als MoP (Metall auf Polyethylen) -Systeme, die bisher in Bezug auf die volumetrische Verschleißrate und andere Parameter verwendet wurden, wie in berichtet . Abbildung 2 zeigt ein Beispiel der MOP- und MoM-Systeme für THA.

Abbildung 2: Links: MoP; rechts: Mama.
Ein weiteres Anwendungsbeispiel von Co-Legierungen, mit dem diese Arbeit in direktem Zusammenhang steht, ist die totale Rekonstruktion des Kiefergelenks. Diese Art von Prothese, bekannt als Christensen-Prothese, wird seit über 30 Jahren verwendet und zeichnet sich durch die Förderung einer stabilen, zuverlässigen und vorhersehbaren Rekonstruktion aus, die eine Verringerung des Schmerzniveaus, eine Verbesserung der Funktionalität und einen höheren Bewegungsgrad ermöglicht . Abbildung 3 zeigt eine kieferorthopädische Prothese.
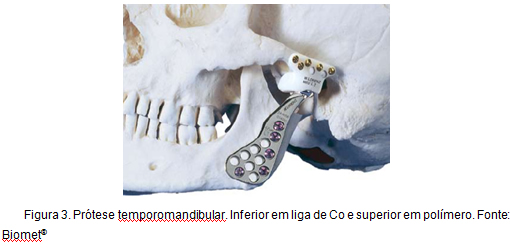
Abbildung 3: Kieferorthopädische Prothese.
Titanlegierungen
Titan – und in jüngerer Zeit seine Legierungen – wurden 1791 von William Gregor, einem britischen Mineralogen, entdeckt und werden seit Jahrzehnten zur Fixierung von Frakturen und zur Gelenkrekonstruktion verwendet, da es die notwendigen Anforderungen für biomedizinische Anwendungen erfüllt, wie: verschleißfestigkeit, Biokompatibilität, Bioadhäsion (Induktion des Knochenwachstums), Elastizitätsmodul (je näher am menschlichen Knochen – 10-30 GPa -, desto besser), Ermüdungsfestigkeit und gute Verarbeitbarkeit , .
Titan hat eine hexagonal geschlossene gepackte (hcp) Struktur in Bezug auf die Alpha-Phase, die bei 881º C für die körperzentrierte kubische (bcc) Struktur, die als Beta-Phase bekannt ist, eine allotrope Veränderung erfahren kann. Die Manipulation dieser kristallographischen Eigenschaften durch Zugabe von Bindemitteln und thermomechanischen Prozessen ermöglicht die Gewinnung von Legierungen mit verschiedenen Eigenschaften.
Die Titanklassen, die ursprünglich als Biomaterialien eingeführt wurden, waren ASTM F67 (kommerziell reines Titan in den Klassen 1, 2, 3 und 4), ASTM F136 (Legierung Ti-6Al-4V Extra Low Interstitial) und ASTM F1472 (Legierung Ti-6Al 4W-Standard) . In diesen Materialien stabilisieren einige Legierungselemente die Alpha-Phase, während andere die Beta-Phase stabilisieren. Man kann die Alpha-Phase stabilisieren, indem man Aluminium, Zinn und Zirkonium einschließt, während die Beta-Phase mit Vanadium, Molybdän, Niob, Chrom, Eisen und Mangan stabilisiert werden kann . Es wird daher angemerkt, dass die Legierung ASTM F136 ein Beispiel für stabilisierte Alpha / Beta-Legierung ist.
Ein Teil der Verschleißfestigkeit, die bei Titan und seinen Legierungen beobachtet wird, beruht auf der Bildung einer passiven Oxidschicht, die hauptsächlich aus TiO2 besteht, die an der Oberfläche des Metalls haftet und es schützt und darüber hinaus weitgehend für die Biokompatibilität des Materials verantwortlich ist. Diese Schicht kann durch anodische Oxidation in Essigsäureelektrolyt erhalten werden und, wenn die Anwesenheit von Titan in Gewebe neben dem Implantat ausgewertet, es ist wesentlich kleiner in dem eloxierten Implantat, wenn im Vergleich zu denen ohne Oberflächenanodisierung , .
Ein schweres Trauma in der Gesichtsstruktur erfordert eine große Anzahl von Platten und Schrauben, und die Titanimplantate sind aufgrund der in diesem Testbericht genannten Eigenschaften besonders geeignet. Es gibt Platten und Schrauben für den kranio-maxillofazialen Bereich in verschiedenen Konfigurationen, so dass der Arzt das System an die Anatomie des Patienten anpassen kann. Abbildung 4 zeigt ein Beispiel für die Anwendung von Titan bei der Fixierung von kranio-maxillofazialen Frakturen.

Abbildung 4: Platten zur Fixierung von kranio-maxillofazialen Frakturen.
Eine weitere Anwendung, die die Vielseitigkeit des Materials demonstriert, findet sich in den Markstäben für geschlossene Tibia- und Verbundfrakturen , wo das Implantat (Abbildung 5) für größere Knochenbrüche angezeigt ist und größeren mechanischen Belastungen ausgesetzt ist (Tibia).
Abbildung 5: Tibia-Markschaft in Ti.
Keramische Biomaterialien
Die Entwicklung keramischer Materialien für biomedizinische Anwendungen konzentriert sich hauptsächlich auf die Bereiche Orthopädie und Zahnmedizin. Es ist eine Klasse von Materialien, die mehrere Merkmale von Biomaterialien enthält. Es hat Vertreter der bioinerten, bioresorbierbaren, bioaktiven und porösen Klassen für das Gewebewachstum .
Das Potenzial der Keramik als Biomaterialien ergibt sich aus ihrer Ähnlichkeit mit der physiologischen Umgebung aufgrund ihrer Grundkonstitution von Ionen, die auch in der physiologischen Umgebung vorkommen (Kalzium, Kalium, Magnesium, Natrium usw.) und andere, deren Toxizität sehr begrenzt ist (Zirkonium und Titan) .
Die bioinerten Keramiken sind repräsentativer in den Verbindungen von Aluminiumoxid (Al2O3), Zirkonoxid (ZrO2) und mit Yttriumoxid (ZrO2 (Y2O3)) stabilisiertem Zirkonoxid. Ihre Fähigkeit, nicht mit dem umgebenden Gewebe zu reagieren, Korrosionsbeständigkeit, hohe Verschleißfestigkeit und hohe mechanische Beständigkeit sind wesentliche Merkmale bei ihrer Verwendung als Gelenkflächen, die Belastungen und Reibung ausgesetzt sind , .
Im Herzen von bioaktiven und bioresorbierbaren Keramiken findet man Verbindungen wie Hydroxylapatit (HA), Calciumphosphate, insbesondere das β-Tricalciumphosphat (β-TCP), sowie die Biogläser und Glaskeramiken, deren Zusammensetzung aus einer breiten Palette von Oxiden (SiO2, P2O5, CaO, CaF2, Na2O, Al2O3, Ta2O5 und TiO2, unter anderem.) .
Park, J; Seen, RS „Biomaterialien – eine Einführung“. Springer. 3ª edição. 2007. s. 2.
Gália, C. A; et al. „Verwendung von homologem und heterologem Transplantat bei der Femurdiaphyse von Ratten: Vergleich zwischen gefrorenem und lyophilisiertem Knochentransplantat“. Brasilianische Zeitschrift für Orthopädie und Traumatologie. März 2005.
Marzola, C; Toledo Filho, JL „Grundlagen der Mund-, Kiefer- und Gesichtschirurgie – Implantate aus alloplastischen Materialien““ Kapitel X.
Pereira, MM; Buono, VTL; Zavaglia, CAC “ Metallische Werkstoffe: Wissenschaft und Anwendung als Biomaterialien. In: Orefice, R. A; Pereira, M. M.; Mansur ,H. S. „Biomaterialien: Grundlagen und Anwendungen““ Rio de Janeiro. Medizinische Kultur, 2006, Kap. 2, S. 39-58.
Bath, S. V. „Biomaterialien“. Narosa Verlag. In: Nova Dheli, India. 2002. p. 181
Santos, L. A. “ Entwicklung von Calciumphosphat reforçado por fibras para uso na área médico-odontológica.“Tese de Doutorado. Staatliche Universität von Campinas. 2002.
Wong, J. Y; Bronzinho, J. D. „Biomaterialien“. Taylor und Francis Gruppe. LLC. 2007. s. 1-1.
Barbucci, R. „Integrierte Biomateriaiswissenschaft“. Kluwer Academic / Plenum Publishers. In: New York.2002. kap.6. s. 289-290.
Bertol, L. S. „Beitrag zur Untersuchung von Rapid Prototyping, dreidimensionaler Digitalisierung und Materialauswahl bei der Konstruktion kundenspezifischer Implantate““ Masterarbeit. Bundesuniversität von Rio Grande do Sul. In: Porto Alegre. 2008.
Donachie M. „Metals Handbook desk Edition“. 2. Auflage, herausgegeben von Davis, J. R. ASM International. 1998.
Disegi, J. A; Kennedy, R. L; Pilliar, R. “ Legierungen auf Kobaltbasis für biomedizinische Anwendungen“. ASTM-STP 1365. 1999.
Shi, D. „Einführung in Biomaterialien“. In: Tsinghua University Press, World Scientific. 2006. p – 123.
Marti, A. „Kobaltbasislegierungen in der Knochenchirurgie“. Verletzung – Internationale Zeitschrift für die Versorgung der Verletzten. 2000 (31).
Wnek, G. E; Bowlin, G. L. „Enzyklopädie der Biomaterialien und Biomedizintechnik“. Band 2. 2ª edição. In: Informa Healthcare. 2008.
Sieber, H. P; Rieker, C. B; Köttig, P. „Analyse von 118 Metall-auf-Metall-Implantaten der zweiten Generation“. Das Journal of Bone & Gelenkchirurgie (Br). 1998;80-B:46-50.
Garret, W. R.; Abtei, P. A; Christensen, R. „Kiefergelenkrekonstruktion mit einer kundenspezifischen Kiefergelenk-Totalprothese: Einsatz beim mehrfach operierten Patienten“. Ein Nachdruck von Surgical Technology International VI.
Leyens, C; Manfred, P. „Titan und Titanlegierungen: Grundlagen und Anwendungen“. Wiley-VCH. Erste Ausgabe. 2003. p – 1.
Yaszemski, M. J; Tantrolo, D. J; Lewandrowski, K; Hasirci, V; Altobelli, D. E; Weise, D. L. „Biomaterialien in der Orthopädie“. Marcel Dekker Inc. 2004. p – 2.
Lütjering, G; Williams, J. C. „Titan – Technische Werkstoffe und Verfahren. In: Springer-Verlag. Zweite Auflage. 2003. p – 399.Brown, SA; Zitronen, JE „Medizinische Anwendungen von Titan und seinen Legierungen: das Material und biologische Probleme“. Tagungsband eines Symposiums 1994 in Phoenix, Arizona. Nr. 1272. ASTM. 1996.
Brunette, D. M; Tengvall, P; Textor, M; Thomsen, P. „Titan in der Medizin: Materialwissenschaft, Oberflächenwissenschaft, Technik, biologische Reaktionen und medizinische Anwendungen“. In: Springer-Verlag. 2001. s. 28.
Larsson, C; Thomsen, P; Aronsson, B. O; Rodahl, M; Lausmaa, J; Kasemo, B; Ericson, L. E. „Knochenreaktion auf oberflächenmodifizierte Titanimplantate: Studien zur frühen Gewebeantwort auf bearbeitete und elektropolierte Implantate mit unterschiedlichen Oxiddicken“. Biomaterias 17 (1996) 605-616. Elsevier .
Jorgenson D. S; Centeno, J. A.; Mayer M. H.; Topper, M.J.; Nossov, P. C.; Mullick, F. G.; Manson, P. N. „Biologische Reaktion auf passive Auflösung von Titan-kraniofazialen Mikroplatten“. Biomaterialien 20 (1999) 675-682. Elsevier.
Zimmer Sirus® – Marknagelsystem. Zimmer, 2007.
Shakelford, J. F. „Biokeramik – Fortgeschrittene Keramik; v. 1“. Gordon und Breach Science Publishers, 1999. p – 5.
Hench, L. L. „Biokeramik: Vom Konzept zur Klinik“. J. Am. In: Ceram. Soc., 74 (7) 1487-510 (1991).
Hench, L. L; Wilson, J. „Eine Einführung in die Biokeramik“. World Scientific Publishing Co, 1993. p – 25.
Bubok, V. A. „Biokeramik – Gestern, heute, morgen“. Pulvermetallurgie und Metallkeramik, Vol. 39, Nr. 7-8, 2000.
Anpassbare Prothesen
Kranio-maxillofaziale Rekonstruktion mittels Rapid Prototyping
Rapid Prototyping ist die Technik der Teilefertigung nach dem additiven Verfahren. Ein in einem CAD-System erstelltes 3D-Modell wird in 2D-Profile unterteilt, die dann von Rapid Prototyping-Geräten Schicht für Schicht konstruiert werden. Heute stehen verschiedene Techniken zur Verfügung, wie zum Beispiel: Stereolithographie (SLA), direktes Metalllasersintern (DMLS), Laser Surface Molded (LSM), Fused Deposition Modeling (FDM), 3D-Druck (3DP) und Elektronenstrahlschweißen (EBW) .
Im ersten Jahrzehnt der Verwendung der DMLS-Technik, von 1994 bis 2004, wurde sie zumindest in ihren kommerziellen Anwendungen von Materialien dominiert, die speziell für den DMLS-Prozess entwickelt wurden, und zwar mit Schwerpunkt auf Verbesserungen der Verarbeitbarkeit und Eigenschaften, die für die gängigsten Anwendungen akzeptabel sind. Heutzutage ist eine breite Palette von Legierungen für den Einsatz in DMLS verfügbar, wie z. B. Leichtlegierungen aus Titan. Von besonderem Interesse im medizinischen Bereich sind die Ti-6Al–4V – Titan, Aluminium, Vanadium und Ticp – kommerziell reines Titan. Beide zeichnen sich durch hervorragende mechanische Eigenschaften, Korrosionsbeständigkeit, geringes spezifisches Gewicht und vor allem durch ihre Biokompatibilität aus.
Traditionell wird Rapid Prototyping (RP) in Industrie und Ingenieurwesen eingesetzt, um in kurzer Zeit zuverlässige Prototypen herzustellen, was zu Kostensteigerungen führt . In letzter Zeit hat RP seine Anwendung über technische Produkte hinaus erweitert. Seine Verwendung im medizinischen Bereich zur Herstellung von kundenspezifischen Implantaten und Prothesen, das Studium der Anatomie, und chirurgische Planung umfassen wichtige Forschungsfelder . Die Berufung auf den medizinischen Bereich steht vor erheblichen Hindernissen, wie der Tatsache, dass ein Fall niemals gleich ist – weshalb eine Standardisierung bei der Herstellung von Implantaten nicht vorteilhaft ist – und Fragen bezüglich der unklaren Punkte des Operationsgebiets die chirurgische Planung erschweren .
Unter den angeborenen Defekten sind kraniofaziale Anomalien (CFA) eine Gruppe sehr vielfältig und komplex, die einen signifikanten Anteil der Menschen auf der Welt betreffen .
Neben den Fällen angeborener Missbildungen gibt es kraniofaziale Defekte, die aufgrund anderer Erkrankungen – zum Beispiel Tumoren – erworben wurden. In den letzten vier Jahrzehnten wurde auch ein wachsendes Volumen von Fällen von Gesichtstraumata beobachtet, was eng mit der Zunahme von Autounfällen und städtischer Gewalt zusammenhängt.
In allen Fällen ist die kranio-maxillofaziale Rehabilitation Teil des Prozesses der Wiedereingliederung von Patienten in die Gesellschaft und der Förderung des Wohlbefindens.
Rapid Prototyping bei der Schädel- und Gesichtsrekonstruktion
Das herkömmliche Mittel zur Herstellung eines Implantats zur Reparatur von Schädeldefekten besteht in der direkten Modellierung des Implantats an der Operationsstelle während der Operation. Der Druck erfolgt in Wachs und wird anschließend zur Herstellung einer Biomaterialform verwendet . Ende der 1980er Jahre erschienen die Ergebnisse der ersten Forschung, die nach einem Weg suchte, ein physikalisches Modell direkt aus einem digitalen dreidimensionalen Modell zu erstellen .
Rapid Prototyping ist ein schichtweises Herstellungsverfahren, mit dem komplexe Geometrien aus einem CAD-Modell hergestellt werden können .
Seine Verwendung in medizinischen Anwendungen hat die Planung komplexer Operationen durch die Konstruktion präoperativer anatomischer Modelle revolutioniert, die es dem medizinischen Personal ermöglichen, jeden Einzelfall kritisch zu bewerten . Es hat auch großen Wert auf seine Verwendung bei der kundenspezifischen Herstellung von Implantaten für die Rekonstruktion des Schädels und der Gesichtsfehler gelegt , , , , .
Bei der Konstruktion kundenspezifischer Implantate ist die Eingabe der Patientendaten erforderlich. Die Daten werden aus CT oder NMRI in 2D-Querschnitten im DICOM-Format erhalten, deren Dicke beim Erhalten der Bilder am Gerät bestimmt wird. Die Anzahl der Slices bestimmt die Bildauflösung und damit das 3D-Modell. Die 2D-Schnitte werden auf die medizinische Modellierungssoftware übertragen, wo es möglich ist, das Schwellensignal einzustellen, um zu erhalten, nach Interpolation, eine 3D-Darstellung der Knochenstruktur, .
Nach dem Erhalt des Modells kann es in CAD-Software für die Modellierung des Implantats, das den Knochendefekt repariert, gehandhabt werden.
Der gemusterte Volumenkörper wird dann in das STL-Format konvertiert und kann mit beliebigen Rapid-Prototyping-Techniken prototypisiert werden.
Aktuelle Anwendungen, Materialien und Fallberichte
Im Bereich der kranio-maxillofazialen Reparatur wurden mehrere Fälle erfolgreicher Anwendung von 3D-Modellierungstechnologien und Rapid Prototyping für kundenspezifische Implantate gemeldet.
Bertol et al. berichtete über die Verwendung von Tomographiebildern bei der Erstellung eines virtuellen 3D-Modells für das virtuelle Resektionsverfahren eines von einem Tumor betroffenen Teils des Kiefers und das anschließende Implantatdesign, um den betroffenen Bereich durch die Technik der Spiegelung durch Symmetrieebene zu ersetzen, wobei der gesunde Teil des Kiefers gespiegelt und bei der Rekonstruktion des entfernten Bereichs verwendet wird.
Abbildung 7: Beschaffungsprozess des 3D-Modells und des Implantats (links). Implantat gebaut von DMLS (rechts) .
Das Implantat wurde aus Titan (Ti-6Al-4V) unter Verwendung der Technik des direkten Metalllasersinterns (DMLS) hergestellt. In diesem Prozess wird das pulverförmige Metall in ein festes Teil durch das lokale Schmelzen geschmolzen, das durch einen Laserstrahl der Hochenergie zur Verfügung gestellt wird, die durch Computer entsprechend dem Entwurf des Teils verwiesen wird.
Nach der Herstellung des Implantats wurde es mit der 3D-Scantechnik für den Dimensionsvergleich mit dem virtuellen Modell gescannt. Die Unterschiede waren nicht größer als 0,05 mm, was die Genauigkeit der Methode demonstriert.
Drstvensek et al berichteten auch über erfolgreiche Fälle, die das große Potenzial von Rapid Prototyping im medizinischen Bereich demonstrieren. In einem berichteten Fall wurde eine schwere Gesichtsasymmetrie (hemifaziale Mikrosomie) behandelt. Die verwendete Methodik ähnelte der von Bertol et al. 3D-Modelle wurden aus CT-Bildern gewonnen und das Implantat wurde in einer virtuellen Umgebung entwickelt, indem der nicht betroffene Teil gespiegelt wurde.
Abbildung 8: Virtuelles Modell des zu konstruierenden Bereichs (links); Implantat hergestellt von DMLS .
In einem anderen von Drstvensek et al . berichteten Fall wurden dieselben Techniken bei der Herstellung eines Schädelimplantats und des posterioren 3D-Scannens zur Dimensionskontrolle verwendet. Im Vergleich zum virtuellen Modell zeigte das Implantat in einigen Regionen Abweichungen von 0,8 bis 1,0 mm. Laut dem Autor wurde das Implantat aufgrund der Tatsache, dass sich die betreffende Region nicht in einem kritischen Teil befindet, genehmigt und erfolgreich implementiert. Die in beiden Fällen verwendete Prototyping-Technik war DMLS und das Material war Ti-6Al-4V.
Abbildung 9: Prothese hergestellt von DMLS (links). Ergebnis der virtuellen Geometrieprüfung (rechts).
In jüngster Zeit haben sich mehrere Studien auf die Eigenschaften bei der Herstellung von Implantaten konzentriert. Dies geschieht beispielsweise in der Kombination von mechanischen Beständigkeitseigenschaften und Titankorrosion mit der Bioaktivität von Keramiken wie HA und α-TCP.
Ning und Zhou bewerteten die Bioaktivität in vitro und in vivo von Biokompositen, die aus HA- und Ti-Pulvern nach der pulvermetallurgischen Methode hergestellt wurden. Mischungen in verschiedenen Anteilen von HA / Ti wurden gemischt und bei 1200 ° C synthetisiert.Die Ergebnisse zeigen, dass die Komposite mit dem höchsten Ti-Gehalt die Fähigkeit haben, die Keimbildung und das Wachstum von Apatit auf ihrer Oberfläche zu induzieren, was das Knochenwachstum ermöglicht und die Metall / Keramik-Biokomposite zu Kandidaten für den Knochenersatz macht.
Kim et al haben dichte und gleichmäßige Filme aus HA und FHA (Hydroxylapatit-Fluor) mit einer Dicke von ~ 5 µm in Titansubstraten unter Verwendung der Sol-Gel-Technik abgeschieden. Das Substrat zeigte ein günstiges Wachstum und eine Proliferation von Osteoblasten, wodurch die Aktivität und Funktion des Substrats erhöht wurde.
In derselben Richtung berichtete Bertol über zwei Fälle mit der Assoziation von Ti und α-TCP. Ein maßgeschneidertes Implantat wurde durch manuelles Formen auf dem physischen Modell des Patienten erhalten, das aus tomographischen Bildern (Orbitalboden) erhalten wurde, während das andere gemäß dem virtuellen Design bearbeitet wurde, das ebenfalls aus tomographischen Bildern (Unterkiefer) erhalten wurde. In beiden Fällen wurden die Implantate mit α-TCP beschichtet und erfolgreich implementiert.
Abbildung 10:
Nicht nur das Titan, sondern auch die Co-Legierungen haben Keramikverbundwerkstoffe verwendet, um einige ihrer Eigenschaften zu verbessern. Yen et al. berichten über die elektrolytische Beschichtung einer Legierung Co-Cr-Mo mit ZrO2 auf eine Hüftprothese. In diesem Fall verringerte das Aufbringen der Beschichtung den Verschleiß der metallischen Komponente gegenüber der polymeren Komponente und verringerte den Reibungskoeffizienten zwischen den Oberflächen.
Khan, S. F.; Dalgarno K. W. „Design von maßgeschneiderten medizinischen Implantaten durch Schichtfertigung“. Fakultät für Maschinenbau und Systemtechnik. NC Universität – Vereinigtes Königreich.
Ma, D; Lin F; Chua CK „Rapid Prototyping-Anwendungen in der Medizin. Teil 1: NURBS-basierte Volumenmodellierung“. Das internationale Journal für fortschrittliche Fertigungstechnologie. In: Springer-Verlag London Limited. 2001
Lima, B. C. „Engenharia Reversa e Prototipagem Rápida: Estudo de Casos“. S. 15-16. 2003.
Shellabear, M; Nyrhilä, O. „DMLS – Entwicklungsgeschichte und Stand der Technik“. LANE, Erlanger. 2004.
Shellabear, M; Nyrhilä, O. “ Fortschritte in Materialien und Eigenschaften von direkten Metalllasersynterteilen“. LANE, Erlanger. 2004.
Molleó, I. L. „Kraniofaziale Anomalien, Genetik und öffentliche Gesundheit: Beiträge zur Anerkennung der aktuellen Versorgungssituation im einheitlichen Gesundheitssystem““ Unicamp. 2004.
Lima Silva, J. J. de; Lima, A. A. A. S.; Torres ,S. M. „Gesichtsfrakturen: Analyse von 105 Fällen““ Revista Brasileira de Cirurgia Craniomaxilofacial / Brasilianische Vereinigung für Cranio-Maxillofacial Surgery. – Vol.12, Nr. 1 (Jan.2009).
Gopakumar, S. “ RP in der Medizin: eine Fallstudie in der kranialen rekonstruktiven Chirurgie““ Rapid Prototyping Journal. Band 10 * Nummer 3 * 2004 * S. 207-211.
Bertol, L. S. „Beitrag zur Untersuchung von Rapid Prototyping, dreidimensionaler Digitalisierung und Materialauswahl bei der Gestaltung kundenspezifischer Implantate““ Masterarbeit. Bundesuniversität von Rio Grande do Sul. In: Porto Alegre. 2008.
Naber, H. „Fortschritte in der Rapid Prototyping-Technologien“, Materialien und Fertigung Konferenz, Metalex, Thailand. 1998.
Gibson, ich; Cheung, LK; Chow, SP; Cheung, WL; gut, SL; Savalani, M; Lee, S. H. „Die Verwendung von Rapid Prototyping zur Unterstützung medizinischer Anwendungen“. Rapid Prototyping Zeitschrift 12/1 (2006) 53-58.
Hench, L. L. „Biokeramik: Vom Konzept zur Klinik“. J. Am. In: Ceram. Soc., 74 (7) 1487-510 (1991).
Wu, W; Shang, Y; Li, H; Wang, W. „Herstellung der Reparatur von Schädelknochendefekten basierend auf dem Rapid Prototyping“. Zeitschrift für bioaktive und verträgliche Polymere, Vol. 24. Mai 2009.
Bertol, L. S; Junior, W. K; Silva, F. P. d. ; Aumund-Kopp, C. „Medizinisches Design: Direktes Metall-Lasersintern von Ti-6Al-4V“. Materialien und Design (2010), doi: 10.1016/j.matdes.2010.02.050.
Oliveira, RSD; Brigato, R; Madureira, JFG; Cruz, AAV; Filho, FVDM; Alonso, N; Machado, HR „Rekonstruktion eines großen komplexen Schädeldefekts bei einem Kind: ein Fallbericht und eine Literaturübersicht“. Childs Nerv Syst (2007) 23:1097-1102.
Drstvensek, I; Hren, NI; Strojnik, T; Brajlih, T; Valentan, B; Pogacar, V; Hartner, T. Z. “ Anwendungen von Rapid Prototyping in kranio-maxilofazialen chirurgischen Verfahren“. Internationale Zeitschrift für Biologie und biomedizinische Technik. Ausgabe 1, Band 2, 2008.
Ning, C. Q; Zhou, Y. „In-vitro-Bioaktivität eines Biokomposits, hergestellt aus HA- und Ti-Pulvern durch pulvermetallurgische Methode. Biomaterialien 23 (2002) 2909-2915.
Ning, C. Q; Zhou, Y. „Korrelationen zwischen der In vitro und in vivo Bioaktivität der Ti / HA-Verbundwerkstoffe, die durch ein pulvermetallurgisches Verfahren hergestellt wurden“. Acta Biomaterialia 4 (2008) 1944-1952.