Chemische Kinetik
Chemische Kinetik
Möglicherweise kennen Sie Säure-Base-Titrationen, bei denen Phenolphthalein als Endpunktindikator verwendet wird. Möglicherweise haben Sie jedoch nicht bemerkt, was passiert, wenn eine Lösung, die Phenolphthalein in Gegenwart von überschüssiger Base enthält, einige Minuten stehen gelassen wird. Obwohl die Lösung anfänglich eine rosa Farbe hat, wird sie allmählich farblos, alsdas Phenolphthalein reagiert mit dem OH-Ion in einer stark basischen Lösung.Die folgende Tabelle zeigt, was mit der Konzentration von Phenolphthalein in einer Lösung passiert, die anfänglich 0,005 M in Phenolphthalein und 0,61 M in OH-Ion betrug. Wie Sie sehen können, wenn diese Daten in der folgenden Grafik aufgetragen sind, nimmt die Phenolphthaleinkonzentration über einen Zeitraum von etwa vier Minuten um den Faktor 10 ab.
Experimental Data for the Reaction Between Phenolphthalein and ExcessBase
| Concentration of Phenolphthalein (M) |
Time (s) | |
| 0.0050 | 0.0 | |
| 0.0045 | 10.5 | |
| 0.0040 | 22.3 | |
| 0.0035 | 35.7 | |
| 0.0030 | 51.1 | |
| 0.0025 | 69.3 | |
| 0.0020 | 91.6 | |
| 0.0015 | 120.4 | |
| 0.0010 | 160.9 | |
| 0.00050 | 230.3 | |
| 0.00025 | 299.6 | |
| 0.00015 | 350.7 | |
| 0.00010 | 391.2 |
Experimente wie die, die uns die Daten in der obigen Tabelle gaben, werden als Messungen der chemischen Kinetik klassifiziert (von einem griechischen Stamm, der „tomove“ bedeutet). Eines der Ziele dieser Experimente ist es, die Reaktionsgeschwindigkeit zu beschreibendie Geschwindigkeit, mit der die Reaktanten in die Reaktionsprodukte umgewandelt werden.
Der Begriff Rate wird häufig verwendet, um die Änderung einer Menge zu beschreibendas tritt pro Zeiteinheit auf. Die Inflationsrate ist zum Beispiel die Änderung Derdurchschnittskosten einer Sammlung von Standardartikeln pro Jahr. Die Geschwindigkeit, mit der sich ein Objekt durch den Raum bewegt, ist die pro Zeiteinheit zurückgelegte Strecke, z. B. Meilen pro Stunde oder Kilometer pro Sekunde. In der chemischen Kinetik ist die zurückgelegte Strecke die Änderung in derkonzentration einer der Komponenten der Reaktion. Die Geschwindigkeit einer Reaktion istdaher die Änderung der Konzentration eines der Reaktanten![]() (X)
(X)![]() , die während eines bestimmten Zeitraums auftritt
, die während eines bestimmten Zeitraums auftritt![]() t.
t.
![]()
Übungsproblem 1:
Verwenden Sie die Daten in der obigen Tabelle, um die Geschwindigkeit zu berechnen, mit der Phenolphthalein mit dem OH-Ion während jeder der folgenden Perioden reagiert:
(a) Während des ersten Zeitintervalls, wenn die Phenolphthaleinkonzentration von 0,0050 M auf 0,0045 M abfällt.
(b) Während des zweiten Intervalls, wenn die Konzentration von 0,0045 M auf 0,0040 M fällt.
(c) Während des dritten Intervalls, wenn die Konzentration von 0,0040 M auf 0,0035 M fällt.
Klicken Sie hier, um Ihre Antwort auf Übungsproblem 1 zu überprüfen.
Klicken Sie hier, um eine Lösung für Problem 1 zu sehen.
![]()
Momentane Reaktionsgeschwindigkeiten und das RateLaw für eine Reaktion
Die Reaktionsgeschwindigkeit zwischen Phenolphthalein und dem OH-Ion ist nicht konstant; sie ändert sich mit der Zeit. Wie die meisten Reaktionen, die Geschwindigkeit dieser Reaktionallmählich abnimmt, wenn die Reaktanten verbraucht werden. Dies bedeutet, dass die Reaktionsrateänderungen während der Messung.
Um den Fehler zu minimieren, den dies in unsere Messungen einführt, scheint es ratsam, die Reaktionsgeschwindigkeit über Zeiträume zu messen, die im Vergleich zur Reaktionszeit kurz sind. Wir könnten zum Beispiel versuchen, die infinitesimal kleine Konzentrationsänderung![]() d(X)
d(X)![]() zu messen, die über einen infinitesimal kurzen Zeitraum auftritt. Das Verhältnis dieser Mengen wird als momentane Reaktionsgeschwindigkeit bezeichnet.
zu messen, die über einen infinitesimal kurzen Zeitraum auftritt. Das Verhältnis dieser Mengen wird als momentane Reaktionsgeschwindigkeit bezeichnet.
![]()
Die momentane Reaktionsgeschwindigkeit zu jedem Zeitpunkt kann berechnet werdenaus einem Graphen der Konzentration des Reaktanten (oder Produkts) gegenüber der Zeit. Die folgende Grafik zeigt, wie die Reaktionsgeschwindigkeit für die Zersetzung von Phenolphthalein aus einem Konzentrations-Zeit-Diagramm berechnet werden kann. Die Reaktionsgeschwindigkeit zu jedem Momentin der Zeit ist gleich der Steigung einer Tangente, die zu diesem Zeitpunkt an diese Kurve gezogen wird.
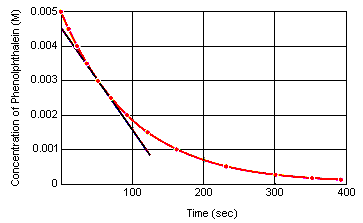
Die momentane Reaktionsgeschwindigkeit kann zu jeder Zeit zwischen Demmoment gemessen werden, in dem die Reaktanten gemischt werden und die Reaktion das Gleichgewicht erreicht.Die Extrapolation dieser Daten zurück zu dem Zeitpunkt, zu dem die Reagenzien gemischt werden, ergibt die anfängliche sofortige Reaktionsgeschwindigkeit.
![]()
Ratengesetze und Ratenkonstanten
Ein interessantes Ergebnis wird erhalten, wenn die momentane Reaktionsrate an verschiedenen Punkten entlang der Kurve in der Grafik im vorherigen Abschnitt berechnet wird. Die Reaktionsgeschwindigkeit an jedem Punkt dieser Kurve ist direktproportional zur Konzentration von Phenolphthalein zu diesem Zeitpunkt.
Rate = k(Phenolphthalein)
Da diese Gleichung ein experimentelles Gesetz ist, das die Reaktionsgeschwindigkeit beschreibt, wird sie als Geschwindigkeitsgesetz für die Reaktion bezeichnet. Die Proportionalitätskonstante k wird als Geschwindigkeitskonstante bezeichnet.
Übungsproblem 2:
Berechnen Sie die Geschwindigkeitskonstante für die Reaktion zwischen Phenolphthalein und dem OH-Ion, wenn die momentane Reaktionsgeschwindigkeit 2 beträgt.5 x 10-5 mol pro Liter pro Sekunde, wenn die Konzentration von Phenolphthalein 0,0025 M beträgt.
Klicken Sie hier, um Ihre Antwort auf Übungsproblem 2 zu überprüfen.
Klicken Sie hier, um eine Lösung für Problem 2 zu sehen.
Übungsproblem 3:
Verwenden Sie die Geschwindigkeitskonstante für die Reaktion zwischen Phenolphthalein und dem OH-Ion, um die anfängliche momentane Reaktionsgeschwindigkeit für die in der vorhergehenden Tabelle aufgeführten experimentellen Daten zu berechnen.
Klicken Sie hier, um Ihre Antwort auf Übungsproblem 3 zu überprüfen.
Klicken Sie hier, um eine Lösung für Problem 3 zu sehen.
![]()
Verschiedene Möglichkeiten, die Reaktionsgeschwindigkeit auszudrücken
Es gibt normalerweise mehr als eine Möglichkeit, die Reaktionsgeschwindigkeit zu messen. Wir können die Zersetzung von Jodwasserstoff untersuchen, indem wir z. B. die Geschwindigkeit messen, mit der entweder H2 oder I2 in der folgenden Reaktion gebildet wird, oder die Rate, mit der HI verbraucht wird.
2 HI(g) H2(g) + I2(g)
Experimentell finden wir, dass die Geschwindigkeit, mit der I2 gebildet wird, istproportional zum Quadrat der HI-Konzentration zu jedem Zeitpunkt.
![]()
Was würde passieren, wenn wir die Geschwindigkeit untersuchen würden, mit der H2 gebildet wird?Die ausgewogene Gleichung legt nahe, dass H2 und I2 gebildet werden müssengenau die gleiche Rate.
![]()
Was würde jedoch passieren, wenn wir die Geschwindigkeit untersuchen würden, mit der HI verbraucht wirdin dieser Reaktion? Da HI verbraucht wird, muss die Änderung seiner Konzentration eine negative Zahl sein. Konventionell wird die Reaktionsgeschwindigkeit immer als positiv ausgegebenzahl. Wir müssen daher das Vorzeichen ändern, bevor wir die Reaktionsgeschwindigkeit für areactant melden, das in der Reaktion verbraucht wird.
![]()
Das negative Vorzeichen bewirkt zwei Dinge. Mathematisch wandelt es ein Negativ umänderung der Konzentration von HI in eine positive Rate. Physikalisch erinnert es uns daran, dasskonzentration des Reaktanten nimmt mit der Zeit ab.
Wie ist die Beziehung zwischen der Reaktionsgeschwindigkeit, die durch Überwachung der Bildung von H2 oder I2 erhalten wird, und der Geschwindigkeit, die durch Beobachtung von HI2 erhalten wird? Die Stöchiometrie der Reaktion besagt, dass für jedes produzierte Molekül H2 oder I2 zwei HI-Moleküle verbraucht werden. Dies bedeutet, dassdie Zersetzungsrate von HI doppelt so schnell ist wie die Geschwindigkeit, mit der H2 und I2 gebildet werden. Wir können diese Beziehung wie folgt in eine mathematische Gleichung übersetzen.
![]()
Infolgedessen ist die Geschwindigkeitskonstante, die aus der Untersuchung der Geschwindigkeit erhalten wird, mit der H2und I2 werden in dieser Reaktion gebildet (k) ist nicht dasselbe wiedie Geschwindigkeitskonstante, die durch Überwachung der Geschwindigkeit erhalten wird, mit der HI verbraucht wird (k ‚)
Übungsproblem 4:
Berechnen Sie die Geschwindigkeit, mit der HI in der folgenden Reaktion verschwindet, wenn I2 mit einer Geschwindigkeit von 1,8 x 10-6 Mol pro Liter pro Sekunde gebildet wird:
2 HI(g) ![]() H2(g) + I2(g)
H2(g) + I2(g)
Klicken Sie hier, um Ihre Antwort auf Übungsproblem 4 zu überprüfen.
Klicken Sie hier, um eine Lösung für Problem 4 zu sehen.
![]()
Das Ratengesetz versus die Stöchiometrie der aReaktion
In den 1930er Jahren untersuchten Sir Christopher Ingold und Mitarbeiter an der Universität von London die Kinetik von Substitutionsreaktionen wie den folgenden.
CH3Br(aq) + OH-(aq)
CH3OH (aq) + Br-(aq)
Sie fanden heraus, dass die Geschwindigkeit dieser Reaktion proportional zur Konzentration beider Reaktanten ist.
Rate = k(CH3Br)(OH-)
Als sie eine ähnliche Reaktion auf einem etwas anderen Startmaterial durchführten, erhielten sie ähnliche Produkte.
(CH3)3CBr(aq) + OH-(aq)![]() (CH3)3COH(aq) + Br-(aq)
(CH3)3COH(aq) + Br-(aq)
Aber jetzt war die Reaktionsgeschwindigkeit proportional zur Konzentration von nureiner der Reaktanten.
Rate = k((CH3)3CBr)
Diese Ergebnisse veranschaulichen einen wichtigen Punkt: Das Geschwindigkeitsgesetz für areaction kann nicht aus der Stöchiometrie der Reaktion vorhergesagt werden; es muss experimentell bestimmt werden. Manchmal stimmt das Geschwindigkeitsgesetz mit dem überein, was wir von derstöchiometrie der Reaktion.
2 HI(g) H2(g) + I2(g)
Rate = k(HI)2
Often, however, it is not.
4 NO2(g) + O2(g)
![]()
Reihenfolge der Molekular
Einige Reaktionen treten in einem einzigen Schritt. Die Reaktion, bei der ein Chloratom von ClNO2 auf NO übertragen wird, um NO2 und ClNO zu bilden, ist ein gutes Beispiel für eine einstufige Reaktion.
ClNO2(g) + NO(g)
NO2(g) + ClNO(g)
Other reactions occur by a series of individual steps. N2O5,for example, decomposes to NO2 and O2 by a three-step mechanism.
| Step 1: | N2O5 |
|
| Schritt 2: | NO2 + NO3 |
|
| Schritt 3: | NO + NO3 |
Die Schritte in einer Reaktion werden in Bezug auf die Molekular von Molekülen verbraucht. Wenn ein singlemolecule verbraucht wird, wird der Schritt unimolecular genannt. Wenn zwei Moleküle verbraucht werden, ist es bimolekular.
Übungsproblem 5:
Bestimmen Sie die Molekularität jedes Schritts in der Reaktion, durch den sich N2O5 zu NO2 und O2 zersetzt.
Klicken Sie hier, um Ihre Antwort auf Übungsproblem 5 zu überprüfen.
Klicken Sie hier, um eine Lösung für Problem 5 zu sehen.
Reaktionen können auch in ihrer Reihenfolge klassifiziert werden. Thedecomposition von N2O5 ist eine Reaktion erster Ordnung, weil therate der Reaktion von der Konzentration von N2O5 abhängt, das zur ersten Energie angehoben wird.
Rate = k(N2O5)
Die Zersetzung von HI ist eine Reaktion zweiter Ordnung, da die Reaktionsrate von der Konzentration von HI abhängt, die auf die zweite Potenz angehoben wird.
Rate = k(HI)2
Wenn die Reaktionsgeschwindigkeit von mehr als einem Reagens abhängt, klassifizieren wir die Reaktion in Bezug auf die Reihenfolge jedes Reagens.
Übungsproblem 6:
Klassifizieren Sie die Reihenfolge der Reaktion zwischen NO und O2 zu NO2:
2 NO(g) + O2(g) ![]() 2 NO2(g)
2 NO2(g)
Nehmen Sie für diese Reaktion das folgende Geschwindigkeitsgesetz an:
Rate = k(NO)2(O2)
Klicken Sie hier, um Ihre Antwort auf Übungsproblem 6 zu überprüfen.
Der Unterschied zwischen der Molekular- und der Ordnungszahl einer Reaktion ist wichtig. Die Molekularität einer Reaktion oder ein Schritt innerhalb einer Reaktion beschreibt, was auf molekularer Ebene geschieht. Die Reihenfolge einer Reaktion beschreibt wasabläuft auf der makroskopischen Skala. Wir bestimmen die Reihenfolge einer Reaktion, indem wir beobachten, wie die Phasen einer Reaktion erscheinen oder die Reaktanten verschwinden. Die Molekular der Reaktionist etwas, das wir ableiten, um diese experimentellen Ergebnisse zu erklären.
![]()
Kollisionstheoretisches Modell chemischer Reaktionen
Das kollisionstheoretische Modell chemischer Reaktionen kann verwendet werden, um die beobachteten Geschwindigkeitsgesetze sowohl für einstufige als auch für mehrstufige Reaktionen zu erklären. Dieses Modell geht davon aus, dass die Geschwindigkeit eines Schritts in einer Reaktion von der Häufigkeit der Kollisionen zwischen den an diesem Schritt beteiligten Partikeln abhängt.
Die folgende Abbildung bietet eine Grundlage für das Verständnis der Implikationen des kollisionstheoretischen Modells für einfache, einstufige Reaktionen wie die folgenden.
ClNO2(g) + NO(g) ![]() NO2(g) + ClNO(g)
NO2(g) + ClNO(g)

Die kinetische Molekültheorie geht davon aus, dass die Anzahl der Kollisionen, die in einem Gas auftreten, von der Anzahl der Partikel pro Liter abhängt. Die Geschwindigkeit, mit der NO2und ClNO bei dieser Reaktion gebildet werden, sollte daher direkt proportional zu den Konzentrationen von ClNO2 und NO sein.
Rate = k(ClNO2)(NO)
Das kollisionstheoretische Modell legt nahe, dass die Rate eines beliebigen Schritts in areaction proportional zu den Konzentrationen der in diesem Schritt verbrauchten Reagenzien ist. Das Reaktionsgesetz für eine einstufige Reaktion sollte daher mit der Stöchiometrie der Reaktion übereinstimmen.
Die folgende Reaktion erfolgt beispielsweise in einem einzigen Schritt.
CH3Br(aq) + OH- (aq) ![]() CH3OH(aq) + Br- (aq)
CH3OH(aq) + Br- (aq)
Wenn diese Moleküle in der richtigen Orientierung kollidieren, kann ein Paar nichtbindender Elektronen auf dem OH-Ion an das Kohlenstoffatom im Zentrum des CH3Br-Moleküls gespendet werden, wie in der folgenden Abbildung gezeigt.

Wenn dies geschieht, bildet sich eine Kohlenstoff-Sauerstoff-Bindung gleichzeitig mit derkohlenstoff-Brom-Bindung ist gebrochen. Das Nettoergebnis dieser Reaktion ist die Substitution eines OH-Ions durch ein Br-Ion. Da die Reaktion in einem einzigen Schritt abläuft, der Kollisionen zwischen den beiden Reaktanten beinhaltet, ist die Geschwindigkeit dieser Reaktion proportional zur Konzentration beider Reaktanten.
Rate = k(CH3Br)(OH-)
Nicht alle Reaktionen finden in einem einzigen Schritt statt. Die folgende Reaktion erfolgt indrei Schritte, wie in der folgenden Abbildung gezeigt.
(CH3)3CBr(aq) + OH-(aq)![]() (CH3)3COH(aq) + Br-(aq)
(CH3)3COH(aq) + Br-(aq)

Im ersten Schritt löst sich das (CH3)3CBr-Molekül in ein Paar Ionen.
| Erster Schritt |  |
Das positiv geladene (CH3)3C+-Ion reagiert dann in einem zweiten Schritt mit Wasser.
| Zweiter Schritt |  |
Das Produkt dieser Reaktion verliert dann im letzten Schritt ein Proton entweder an das OH-Ion oder an Wasser.
| Dritter Schritt |  |
Der zweite und dritte Schritt in dieser Reaktion sind sehr viel schneller alserster.
| (CH3)3CBr |
Slow step | |
| (CH3)3C+ + H2O |
Fast step | |
| (CH3)3COH2+ + OH- |
Fast step |
The overall rate of reaction is therefore more or less equal to the rateof the first step. Der erste Schritt wird daher als geschwindigkeitsbegrenzender Schritt in dieser Reaktion bezeichnet, da er buchstäblich die Geschwindigkeit begrenzt, mit der die Reaktionsprodukte gebildet werden können. Da nur ein Reagens an dem geschwindigkeitsbegrenzenden Schritt beteiligt ist, ist die Gesamtreaktionsrate proportional zur Konzentration nur dieses Reagens.
Rate = k((CH3)3CBr)
Das Geschwindigkeitsgesetz für diese Reaktion unterscheidet sich daher von dem, was wir aus der Stöchiometrie der Reaktion vorhersagen würden. Obwohl die Reaktion sowohl (CH3) 3CBRANDOH- verbraucht, ist die Reaktionsgeschwindigkeit nur proportional zur Konzentration von (CH3) 3CBr.
Die Geschwindigkeitsgesetze für chemische Reaktionen können durch Folgendes erklärt werdenallgemeine Regeln.
Die Geschwindigkeit eines beliebigen Schritts in einer Reaktion ist direkt proportional zu den Konzentrationen der in diesem Schritt verbrauchten Reagenzien.
Das Gesamtratengesetz für eine Reaktion wird durch die Abfolge der Schritte oder den Mechanismus bestimmt, durch den die Reaktanden in die Reaktionsprodukte umgewandelt werden.
Das allgemeine Geschwindigkeitsgesetz für eine Reaktion wird durch das Geschwindigkeitsgesetz für den langsamsten Schritt in der Reaktion dominiert.
