Generic Name: epinastine hydrochloride
Dosage Form: ophthalmic solution
Medically reviewed by Drugs.com. Last updated on June 1, 2020.
- Overview
- Side Effects
- Dosage
- Professional
- Pregnancy
- More
Indications and Usage for Epinastine HCl Ophthalmic Solution
Epinastine HCl Ophthalmic Solution 0.05% ist zur Vorbeugung von Juckreiz im Zusammenhang mit allergischer Konjunktivitis indiziert.
Epinastine HCl Ophthalmic Solution Dosierung und Verabreichung
Die empfohlene Dosierung beträgt zweimal täglich einen Tropfen in jedes Auge.
Die Behandlung sollte während der gesamten Expositionsdauer fortgesetzt werden (d. H. Bis die Pollensaison vorbei ist oder bis die Exposition gegenüber dem betreffenden Allergen beendet ist), auch wenn keine Symptome vorliegen.
Darreichungsformen und Stärken
Lösung mit 0.5 mg/ ml Epinastin HCl
Kontraindikationen
Keine
Warnhinweise und Vorsichtsmaßnahmen
Kontamination von Spitze und Lösung
Die Patienten sollten angewiesen werden, die Spitze des Dosierbehälters nicht mit dem Auge, den umgebenden Strukturen, den Fingern oder einer anderen Oberfläche in Kontakt zu bringen, um eine Kontamination der Lösung durch häufige Bakterien zu vermeiden, von denen bekannt ist, dass sie Augeninfektionen verursachen. Durch die Verwendung kontaminierter Lösungen können schwere Augenschäden und anschließender Sehverlust auftreten.
Flasche sollte bei Nichtgebrauch dicht verschlossen gehalten werden.
Verwendung mit Kontaktlinsen
Patienten sollten darauf hingewiesen werden, keine Kontaktlinsen zu tragen, wenn ihr Auge rot ist. Epinastine HCl Ophthalmic Solution 0, 05% sollte nicht zur Behandlung von kontaktlinsenbedingten Reizungen angewendet werden.
Das Konservierungsmittel in Epinastin HCl Ophthalmic Solution 0,05%, Benzalkoniumchlorid, kann von weichen Kontaktlinsen absorbiert werden. Kontaktlinsen sollten vor der Instillation von Epinastin HCl Ophthalmic Solution 0, 05% entfernt werden und können nach 10 Minuten nach der Verabreichung wieder eingesetzt werden.
Nur zur topischen ophthalmischen Anwendung
Epinastine HCl Ophthalmic Solution 0.05% ist nur zur topischen ophthalmischen Anwendung und nicht zur Injektion oder oralen Anwendung bestimmt.
Nebenwirkungen
Klinische Studienerfahrung
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in klinischen Studien eines Arzneimittels beobachteten Nebenreaktionsraten nicht direkt mit den Raten in klinischen Studien eines anderen Arzneimittels verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Die am häufigsten berichteten Nebenwirkungen am Auge, die bei etwa 1-10% der Patienten auftraten, waren Brennen im Auge, Follikulose, Hyperämie und Pruritus.
Die am häufigsten berichteten nicht-okulären Nebenwirkungen waren Infektionen (Erkältungssymptome und Infektionen der oberen Atemwege), die bei etwa 10% der Patienten auftraten, und Kopfschmerzen, Rhinitis, Sinusitis, vermehrter Husten und Pharyngitis, die bei etwa 1 – 3% der Patienten auftraten.
Einige dieser Reaktionen ähnelten der untersuchten Grunderkrankung.
Erfahrungen nach Markteinführung
Die folgenden Reaktionen wurden während der Anwendung von Epinastin HCl Ophthalmic Solution 0, 05% nach Markteinführung in der klinischen Praxis festgestellt. Da sie freiwillig aus einer Population unbekannter Größe gemeldet werden, können keine Schätzungen der Häufigkeit vorgenommen werden. Die Reaktionen, die entweder aufgrund ihres Schweregrads, ihrer Häufigkeit der Berichterstattung, ihres möglichen ursächlichen Zusammenhangs mit Epinastin HCl Ophthalmic Solution 0, 05% oder einer Kombination dieser Faktoren für die Aufnahme ausgewählt wurden, umfassen: Tränenfluss erhöht.
ANWENDUNG IN BESTIMMTEN POPULATIONEN
Trächtigkeit
Teratogene Wirkungen
Trächtigkeitskategorie C
In einer embryofetalen Entwicklungsstudie an trächtigen Ratten wurde eine maternale Toxizität ohne embryofetale Wirkungen bei einer oralen Dosis beobachtet, die etwa dem 150.000-fachen der maximal empfohlenen humanen Augendosis (MROHD) von 0,0014 mg/kg/Tag auf mg/kg-Basis entsprach. Totale Resorptionen und Aborte wurden in einer embryofetalen Studie an trächtigen Kaninchen bei einer oralen Dosis beobachtet, die etwa dem 55.000-fachen der MROHD entsprach. In beiden Studien wurden keine arzneimittelinduzierten teratogenen Wirkungen festgestellt.
Epinastin reduzierte die Gewichtszunahme der Welpen nach einer oralen Dosis an trächtigen Ratten, die etwa dem 90.000-fachen der MROHD entsprach.
Es gibt jedoch keine adäquaten und gut kontrollierten Studien bei Schwangeren. Da tierexperimentelle Reproduktionsstudien das Ansprechen des Menschen nicht immer vorhersagen können, sollte Epinastin HCl Ophthalmic Solution 0, 05% während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Fötus rechtfertigt.
Stillende Mütter
Eine Studie an laktierenden Ratten ergab eine Ausscheidung von Epinastin in die Muttermilch. Es ist nicht bekannt, ob dieses Arzneimittel in die Muttermilch übergeht. Da viele Arzneimittel in die Muttermilch übergehen, ist Vorsicht geboten, wenn Epinastin HCl Ophthalmic Solution 0, 05% einer stillenden Frau verabreicht wird.
Pädiatrische Anwendung
Sicherheit und Wirksamkeit bei pädiatrischen Patienten unter 2 Jahren wurden nicht nachgewiesen.
Geriatrische Anwendung
Insgesamt wurden keine Unterschiede in der Sicherheit oder Wirksamkeit zwischen älteren und jüngeren Patienten beobachtet.
Epinastin HCl Ophthalmische Lösung Beschreibung
Epinastin HCl Ophthalmische Lösung 0.05% is a clear, colorless, sterile isotonic solution containing epinastine HCl, an antihistamine and an inhibitor of histamine release from the mast cell for topical administration to the eyes.
Epinastine HCl is represented by the following structural formula:
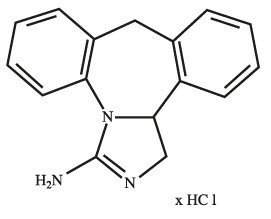
C16H15N3HCl Mol. Wt. 285.78
Chemical Name:
3-Amino-9,13b-dihydro-1H-dibenzimidazoazepine hydrochloride
Each mL contains: Active: Epinastine HCl 0.05% (0.5 mg/mL) equivalent to epinastine 0.044% (0.44 mg/mL); Preservative: Benzalkonium chloride 0.01%; Inactives: Edetat Dinatrium, Dihydrat; gereinigtes Wasser; Natriumchlorid; Natriumphosphat, einbasig, wasserfrei; und Natriumhydroxid und / oder Salzsäure (zur Einstellung des pH-Werts).
Epinastin HCl Ophthalmische Lösung 0,05% hat einen pH-Wert von ungefähr 7 und einen Osmolalitätsbereich von 250 bis 310 mOsm / kg.
Epinastin HCl Ophthalmische Lösung – Klinische Pharmakologie
Wirkmechanismus
Epinastin ist ein topisch aktiver, direkter H1-Rezeptorantagonist und ein Inhibitor der Freisetzung von Histamin aus der Mastzelle. Epinastin ist selektiv für den Histamin-H1-Rezeptor und hat eine Affinität für den Histamin-H2-Rezeptor. Epinastin besitzt auch eine Affinität zu den α1-, α2– und 5-HT2-Rezeptoren.
Pharmakokinetik
Vierzehn Probanden mit allergischer Konjunktivitis erhielten 7 Tage lang zweimal täglich einen Tropfen Epinastin HCl-Augenlösung 0, 05% in jedes Auge. Am Tag 7 wurden nach etwa zwei Stunden durchschnittliche maximale Epinastin-Plasmakonzentrationen von 0,04±0,014 ng/ml erreicht, was auf eine geringe systemische Exposition hinweist. Während diese Konzentrationen einen Anstieg gegenüber denen nach einer Einzeldosis darstellten, blieben die AUC-Werte (Area Under the Curve) an Tag 1 und Tag 7 unverändert, was darauf hindeutet, dass die systemische Resorption bei Mehrfachdosierung nicht zunimmt. Epinastin ist zu 64% an Plasmaproteine gebunden. Die systemische Gesamtclearance beträgt etwa 56 l/h und die terminale Plasmaeliminationshalbwertszeit beträgt etwa 12 Stunden. Epinastin wird hauptsächlich unverändert ausgeschieden. Etwa 55% einer intravenösen Dosis werden unverändert im Urin und etwa 30% im Kot wiedergefunden. Weniger als 10% werden metabolisiert. Die renale Ausscheidung erfolgt hauptsächlich über aktive tubuläre Sekretion.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fertilität
In 18-Monats- oder 2-Jahres-Studien zur Karzinogenität bei Mäusen bzw. Ratten war Epinastin in Dosen von bis zu 40 mg/ kg nicht karzinogen .
Epinastin in neu synthetisierten Chargen war im Ames / Salmonella-Assay und im In-vitro-Chromosomenaberrationstest mit menschlichen Lymphozyten negativ auf Mutagenität. Positive Ergebnisse wurden mit frühen Chargen von Epinastin in zwei In-vitro-Chromosomenaberrationsstudien beobachtet, die in den 1980er Jahren mit menschlichen peripheren Lymphozyten bzw. mit V79-Zellen durchgeführt wurden. Epinastin war in den In-vivo-Studien zur Klastogenität, einschließlich des Maus-Mikronukleus-Assays und des Chromosomenaberrations-Assays bei chinesischen Hamstern, negativ. Epinastin war auch im Zelltransformationstest mit syrischen Hamsterembryozellen, im V79 / HGPRT-Säugetierzellpunktmutationstest und im in vivo / in vitro ungeplanten DNA-Synthesetest mit primären Hepatozyten der Ratte negativ.
Epinastin hatte keinen Einfluss auf die Fertilität männlicher Ratten. Eine verminderte Fertilität bei weiblichen Ratten wurde bei einer oralen Dosis bis zum etwa 90.000-fachen der MROHD beobachtet.
Klinische Studien
Es wurde gezeigt, dass Epinastin HCl 0,05% dem Vehikel zur Verbesserung des Augenjuckens bei Patienten mit allergischer Konjunktivitis in klinischen Studien mit zwei verschiedenen Modellen signifikant überlegen ist: (1) conjunctival Antigen Challenge (CAC), bei der Patienten dosiert wurden und dann Antigen in den Fornix conjunctivalis inferior; und (2) Umweltfeldstudien, bei denen Patienten während der Allergiesaison in ihrem natürlichen Lebensraum dosiert und bewertet wurden. Die Ergebnisse zeigten einen schnellen Wirkungseintritt von Epinastin HCl 0,05% innerhalb von 3 bis 5 Minuten nach konjunktivaler Antigen-Challenge. Es wurde gezeigt, dass die Wirkungsdauer 8 Stunden betrug, was ein zweimal tägliches Regime geeignet macht. Dieses Dosierungsschema erwies sich bis zu 8 Wochen lang als sicher und wirksam, ohne Anzeichen einer Tachyphylaxie.
Wie geliefert/Lagerung und Handhabung
Epinastine HCl Ophthalmic Solution 0.05% wird steril in undurchsichtigen weißen LDPE-Kunststoffflaschen mit Tropfspitzen und weißen Polypropylen (PP) -Kappen wie folgt geliefert:
| 5 ml in 10 ml Flasche | NDC 51991-836-75 |
Lagerung: Bei 20° – 25°C (68° – 77°F) lagern. Flasche fest verschlossen und außerhalb der Reichweite von Kindern aufbewahren.
Informationen zur Patientenberatung
Sterilität der Tropfspitze
Patienten sollten darauf hingewiesen werden, die Tropfspitze nicht mit einer Oberfläche zu berühren, da dies den Inhalt kontaminieren kann (siehe WARNHINWEISE UND VORSICHTSMAßNAHMEN, 5.1).
Gleichzeitige Anwendung von Kontaktlinsen
Patienten sollten angewiesen werden, keine Kontaktlinsen zu tragen, wenn ihr Auge rot ist. Die Patienten sollten darauf hingewiesen werden, dass Epinastin HCl Ophthalmic Solution 0, 05% nicht zur Behandlung von kontaktlinsenbedingten Reizungen angewendet werden darf. Patienten sollten auch angewiesen werden, Kontaktlinsen vor der Instillation von Epinastin HCl Ophthalmic Solution 0,05% zu entfernen.
Das Konservierungsmittel in Epinastin HCl Ophthalmic Solution 0,05%, Benzalkoniumchlorid, kann von weichen Kontaktlinsen absorbiert werden. Die Linsen können nach 10 Minuten nach Verabreichung von Epinastine HCl Ophthalmic Solution 0,05% wieder eingesetzt werden
Nur zur topischen ophthalmischen Anwendung
Nur zur topischen ophthalmischen Anwendung.
Nur Rx
Vertrieben von:
Breckenridge Pharmaceutical, Inc.
Berlin, CT 06037
Hergestellt von:
PrimaPharma, Inc.
San Diego, CA 92121
Rev: 04/2020
2323 04/20
PRINCIPAL DISPLAY PANEL – 5 mL Bottle Carton
NDC 51991-836-75
Epinastine HCl
Ophthalmic
Solution,
0.05%
FOR USE IN THE
EYES ONLY
sterile
Rx Only
5 mL sterile
breckenridge
A Towa
Company

| EPINASTINE HYDROCHLORIDE epinastine hydrochloride solution/ drops |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Labeler – Breckenridge Pharmaceutical, Inc. (150554335)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| PrimaPharma, Inc. | 079699106 | MANUFACTURE(51991-836) | |
Mehr über Epinastine ophthalmic
- Nebenwirkungen
- Während der Schwangerschaft oder Stillzeit
- Dosierungsinformationen
- Preise & Gutscheine
- Auf Englisch
- 3 Bewertungen
- : ophthalmische Antihistaminika und abschwellende Mittel
Verbraucherressourcen
- Patienteninformationen
- Epinastine Ophthalmic (Advanced Reading)
Professionelle Ressourcen
- Verschreibungsinformationen
- Epinastin (Professionelle Patientenberatung)
Andere Marken Elestat
Verwandte Behandlungsleitfäden
- Konjunktivitis, allergisch
Medizinischer Haftungsausschluss