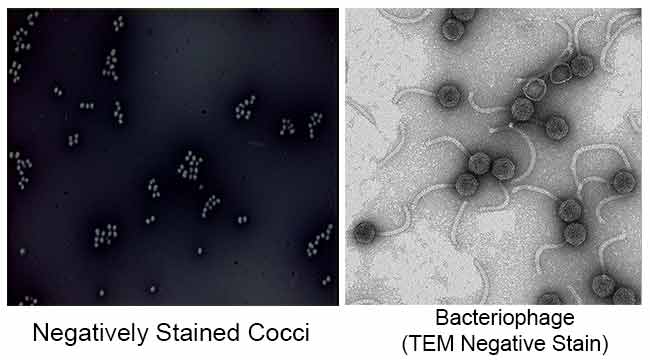
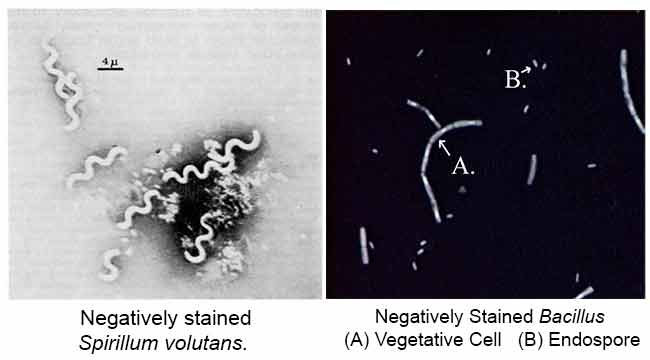
Der Hauptzweck der Negativfärbung besteht darin, die morphologische Form, Größe und Anordnung der schwer zu färbenden Bakterienzellen zu untersuchen. zB: Spirilla. Es kann auch verwendet werden, um Zellen zu färben, die zu empfindlich sind, um hitzefixiert zu werden.
Es wird auch verwendet, um biologische Proben für die Elektronenmikroskopie vorzubereiten. Es wird verwendet, um Viren, Bakterien, bakterielle Flagellen, biologische Membranstrukturen und Proteine oder Proteinaggregate zu betrachten, die alle eine geringe Elektronenstreuleistung aufweisen. Es wird auch für die Untersuchung und Identifizierung von wässrigen Lipidaggregaten wie lamellaren Liposomen (le), invertierten sphärischen Mizellen (M) und invertierten hexagonalen HII zylindrischen (H) Phasen durch negative Färbung Transmissionselektronenmikroskopie verwendet.
Prinzip der Negativfärbung
Die Negativfärbung erfordert einen sauren Farbstoff wie Tusche oder Nigrosin.
Tusche oder Nigrosin ist ein saurer Fleck. Dies bedeutet, dass der Fleck leicht ein Wasserstoffion (Proton) abgibt und der Chromophor des Farbstoffs negativ geladen wird. Da die Oberfläche der meisten Bakterienzellen negativ geladen ist, stößt die Zelloberfläche den Fleck ab. Das Glas des Objektträgers färbt sich, die Bakterienzellen jedoch nicht. Die Bakterien zeigen sich als klare Flecken vor einem dunklen Hintergrund.
Reagenzien der negativen Färbung
Tusche
Nigrosin
Nigrosin 100 g/l, Formalin 5 ml/l in Wasser
Verfahren der negativen Färbung
1. Legen Sie einen sehr kleinen Tropfen (mehr als eine Schlaufe voll, weniger als ein frei fallender Tropfen aus der Pipette) Nigrosin in die Nähe eines Endes eines gut gereinigten und geflammten Objektträgers.
2. Entfernen Sie eine kleine Menge der Kultur mit einer Impfschlaufe aus der Schräge und verteilen Sie sie im Fleckentropfen, ohne den Tropfen zu verteilen.

3. Verwenden Sie einen anderen sauberen Objektträger, um den Fleckentropfen, der den Organismus enthält, mit der folgenden Technik zu verteilen.

4. Legen Sie ein Ende des sauberen Objektträgers mit dem Fleck auf die Mitte des Objektträgers. Kippen Sie den sauberen Schieber in Richtung des Tropfens, der einen spitzen Winkel bildet, und ziehen Sie diesen Schieber in Richtung des Tropfens, bis er den Tropfen berührt und bewirkt, dass er sich entlang der Kante des Spreizschiebers ausbreitet. Halten Sie einen kleinen spitzen Winkel zwischen den Objektträgern ein und drücken Sie den Spreizschieber in Richtung des sauberen Endes des Objektträgers, der befleckt ist, indem Sie den Tropfen hinter den Spreizschieber ziehen und einen breiten, gleichmäßigen, dünnen Abstrich erzeugen.
 |
 |
5. Lassen Sie den Abstrich ohne Erhitzen trocknen.

6. Fokussieren Sie einen dünnen Bereich unter Ölimmersion und beobachten Sie die ungefärbten Zellen, die vom grauen Fleck umgeben sind.
Verfahren zur Ansicht im Transmissionselektronenmikroskop (TEM)
- Halten Sie eine beschichtete Gitterfolie mit einer Selbstklemmzange nach oben.
- Machen Sie eine 1:1-Mischung aus Probe und Negativfärbung (z. 2% Uranylacetat oder 2% Natrium- oder Kaliumphosphowolframat, pH 7,4). Fügen Sie 5µl dem Gitter hinzu. Kleinere Partikel adsorbieren schneller an der Gitteroberfläche als größere Partikel.
Alternativ kann die mit Fixiermittel gemischte Probe vor der anschließenden Negativfärbung in das Gitter gegeben werden. - 30-90 Sekunden inkubieren und dann überschüssige Flüssigkeit mit der abgerissenen Kante eines
Stücks Filterpapier entfernen. - An der Luft trocknen und im TEM untersuchen.
Ergebnisse der negativen Färbung