Identifizieren Sie das saurste H eines Moleküls
Ein methodischer Ansatz funktioniert am besten. Einfach ausgedrückt, müssen Sie das Molekül nach sauren funktionellen Gruppen durchsuchen und dann die Reaktivität dieser Gruppen bewerten. Die am meisten saure funktionelle Gruppe enthält normalerweise das am meisten saure H im gesamten Molekül.
„Scan and rank“ klingt einfach, birgt aber einige Schwierigkeiten, die im Folgenden näher erläutert werden.
Scannen eines Moleküls nach bekannten sauren funktionellen Gruppen
Saure Protonen sind normalerweise an O oder N gebunden. Daher besteht der erste Schritt darin, nach allen OH- und NH-Bindungen zu suchen.Wenn Sie jedoch OH- und NH-Bindungen lokalisieren, müssen Sie entscheiden, ob diese gebundenen Atome in eine funktionelle Gruppe mit benachbarten Atomen zusammengefasst werden sollen.
Die EINZIGE bequeme Methode zur Identifizierung einer funktionellen Gruppe besteht darin, einige bereits zu kennen. Wenn Sie beispielsweise wissen, dass ROH, RCO2H und RSO3H übliche saure funktionelle Gruppen sind, haben Sie keine Probleme, saure Gruppen im folgenden Molekül zu finden (die richtigen Gruppen sind rot markiert).
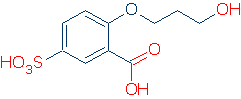
OH- und NH-Säure getrennt einstufen
Die pKa-Werte üblicher OH- und NH-Säuren erstrecken sich über weite Bereiche und ihre Bereiche überlappen sich. Das Ranking verläuft schneller, wenn Sie die OH- und NH-Säuren getrennt einstufen und dann die Top-Kandidaten in jeder Kategorie vergleichen.
Die bequemste Methode zur Einstufung saurer Gruppen besteht darin, ihre charakteristischen pKa-Werte bereits zu kennen. Wenn Sie diese Werte für alle sauren Gruppen in Ihrem Molekül kennen, enthält die Gruppe mit der niedrigsten pKa das saurste H. Fall abgeschlossen.
Wenn Sie sich nicht an die pKa-Werte für alle sauren Gruppen erinnern, können Sie sich an einige allgemeine Grundsätze halten.
#1 Bedeutung – positiv geladene Säuren sind stärker als neutrale Säuren. Negativ geladene Säuren sind selten sauer. Wenn Sie die pKa-Werte gängiger OH-Säuren vergleichen, werden Sie feststellen, dass ROH2 + -Säuren (einschließlich H3O + und R2OH +) erheblich stärker sind als neutrale Säuren wie RCO2H, PhOH und ROH. Die einzigen neutralen Säuren, die stärker als ROH2 + sind, sind H2SO4 und bestimmte andere RSO3H.
Die formale Ladungsregel gilt noch stärker für NH-Säuren. Der Unterschied in pKa zwischen H3O + und H2O beträgt 18 Einheiten, während der Unterschied in pKa zwischen NH4 + und NH3 gigantische 26 Einheiten beträgt.
#2 Bedeutung – Suchen Sie nach aktivierenden Gruppen, einschließlich RSO2, RC= O und Ph. Die folgende Tabelle zeigt, wie jede Gruppe von Atomen eine OH-Säure aktiviert (pKa-Werte reichen von 16 bis -2):
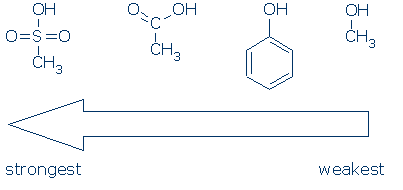
CH3 wird überall dort als Zuschauergruppe betrachtet, wo es in diesen Molekülen vorkommt. Es ist unpolar und übt keinen signifikanten feldinduktiven Effekt aus, und es ist nicht in der Lage, Ladung zu delokalisieren. Folglich ist es möglich, CH3 durch andere funktionelle Gruppen (zum Beispiel H und andere R) zu ersetzen, ohne die Reaktivität stark zu beeinträchtigen.
Zwei zusätzliche Punkte sollten bezüglich aktivierender Gruppen gemacht werden.
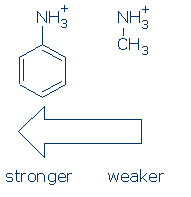
Erstens üben die Gruppen eine ähnliche Wirkung auf NH-Säuren aus (und die Aktivierungssequenz ist dieselbe: RSO2 > RC=O > Ph). Wie es passiert, müssen Sie nur die Wirkung von Ph auf NH + für diesen Kurs lernen:
Zweitens müssen die aktivierenden Gruppen direkt an die OH- (oder NH-) Gruppe gebunden sein, um sie zu aktivieren. Die folgenden Verbindungen haben ähnliche pKa-Werte, da die aktivierenden Gruppen nicht direkt an OH gebunden sind: CH3C (= O) CH2OH, PhCH2OH und CH3CH2OH.
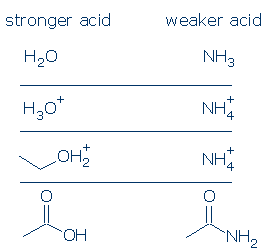
# 3 Bedeutung – wenn alle Dinge gleich sind, ist eine OH-Säure saurer als eine NH-Säure. Dieses Prinzip kann bei richtiger Anwendung sehr nützlich sein. Mein Anliegen ist es, dass Sie verstehen, was unter „alle Dinge gleich.“ Dies bedeutet, dass O und N dieselbe formale Ladung haben müssen (Punkt 1) und an dieselbe aktivierende Gruppe gebunden sein müssen (Punkt 2). Unterschiede in den Zuschauergruppen spielen jedoch keine Rolle.
Einige gültige Vergleiche umfassen:
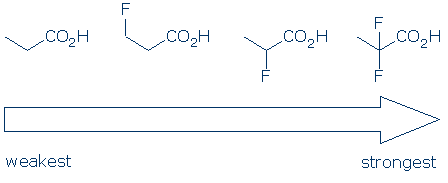
# 4 Bedeutung – Verwenden Sie innerhalb einer funktionellen Gruppenkategorie Substituenteneffekte, um Säuren zu vergleichen. Elektronegative Substituenten verstärken normalerweise die Acidität einer funktionellen Gruppe durch eine Kombination von Feld- und Induktionseffekten. Diese Effekte werden verstärkt, wenn 1) der Substituent näher an der sauren Gruppe liegt und 2) mehrere Substituenten vorhanden sind. Angesichts dieser Prinzipien erwarten wir, dass die Acidität dieser Carbonsäuren diesem Trend folgt: