Generic Name: epinastine hydrochloride
Dosage Form: ophthalmic solution
Medically reviewed by Drugs.com. Last updated on June 1, 2020.
- Overview
- Side Effects
- Dosage
- Professional
- Pregnancy
- More
Indications and Usage for Epinastine HCl Ophthalmic Solution
Epinastine HCl Ophthalmic Solution 0.el 05% está indicado para la prevención de la picazón asociada con la conjuntivitis alérgica.
Epinastine HCl, Solución Oftálmica Dosis y vía de Administración
La dosis recomendada es de una gota en cada ojo dos veces al día.
El tratamiento debe continuarse durante todo el período de exposición (es decir, hasta que termine la temporada de polen o hasta que termine la exposición al alérgeno ofensivo), incluso cuando no haya síntomas.
Formas farmacéuticas y concentraciones
Solución que contiene 0.5 mg/ml de ácido clorhídrico de epinastina
Contraindicaciones
Ninguna
Advertencias y precauciones
Contaminación de la punta y la Solución
Se debe indicar a los pacientes que eviten que la punta del envase dispensador entre en contacto con el ojo, las estructuras circundantes, los dedos o cualquier otra superficie para evitar la contaminación de la solución por bacterias comunes que se sabe que causan infecciones oculares. El uso de soluciones contaminadas puede ocasionar daños graves en el ojo y la consiguiente pérdida de la visión.
El frasco debe mantenerse bien cerrado cuando no esté en uso.
Uso con lentes de contacto
Se debe aconsejar a los pacientes que no usen lentes de contacto si sus ojos están rojos. La solución oftálmica de ácido clorhídrico de epinastina al 0,05% no se debe usar para tratar la irritación relacionada con las lentes de contacto.
El conservante en Solución oftálmica HCl de Epinastina al 0,05%, cloruro de benzalconio, puede ser absorbido por lentes de contacto blandas. Las lentes de contacto se deben quitar antes de la instilación de Solución oftálmica de HCl de Epinastina al 0,05% y se pueden volver a insertar después de 10 minutos después de su administración.
Uso Oftálmico Tópico Únicamente
Solución Oftálmica de HCl de Epinastina 0.el 05% es solo para uso oftálmico tópico y no para inyección ni uso oral.
Reacciones adversas
Experiencia en estudios clínicos
Debido a que los estudios clínicos se realizan en condiciones muy variables, las tasas de reacciones adversas observadas en los estudios clínicos de un medicamento no pueden compararse directamente con las tasas en los estudios clínicos de otro medicamento y pueden no reflejar las tasas observadas en la práctica.
Las reacciones adversas oculares notificadas con mayor frecuencia que ocurrieron en aproximadamente el 1-10% de los pacientes fueron sensación de ardor en el ojo, foliculosis, hiperemia y prurito.
Las reacciones adversas no oculares notificadas con mayor frecuencia fueron infecciones (síntomas de resfriado e infecciones de las vías respiratorias superiores), observadas en aproximadamente el 10% de los pacientes, y cefalea, rinitis, sinusitis, aumento de la tos y faringitis, observadas en aproximadamente el 1-3% de los pacientes.
Algunas de estas reacciones fueron similares a la enfermedad subyacente en estudio.
Experiencia postcomercialización
Se han identificado las siguientes reacciones durante el uso postcomercialización de Solución oftálmica HCl de Epinastina al 0,05% en la práctica clínica. Debido a que se notifican voluntariamente de una población de tamaño desconocido, no se pueden hacer estimaciones de la frecuencia. Las reacciones, que se han elegido para su inclusión debido a su gravedad, frecuencia de notificación, posible conexión causal con Solución Oftálmica de HCl de Epinastina al 0,05%, o una combinación de estos factores, incluyen: aumento del lagrimeo.
USO EN POBLACIONES ESPECÍFICAS
Embarazo
Efectos teratogénicos
Categoría de embarazo C
En un estudio de desarrollo embriofetal en ratas gestantes, se observó toxicidad materna sin efectos embriofetales a una dosis oral que fue aproximadamente 150.000 veces la dosis máxima humana ocular recomendada (ERM) de 0,0014 mg/kg/día en mg / kg. Se observaron reabsorciones totales y abortos en un estudio embriofetal en conejas gestantes a una dosis oral que fue aproximadamente 55.000 veces la ERM. En ambos estudios no se observaron efectos teratogénicos inducidos por fármacos.
La epinastina redujo el aumento de peso corporal de las crías tras una dosis oral a ratas preñadas que fue aproximadamente 90.000 veces superior a la ERM.
No existen, sin embargo, estudios adecuados y bien controlados en mujeres embarazadas. Debido a que los estudios de reproducción en animales no siempre predicen la respuesta humana, la Solución oftálmica de ácido clorhídrico de epinastina al 0,05% se debe usar durante el embarazo solo si el beneficio potencial justifica el riesgo potencial para el feto.
Madres lactantes
Un estudio en ratas lactantes reveló excreción de epinastina en la leche materna. No se sabe si este medicamento se excreta en la leche materna. Debido a que muchos medicamentos se excretan en la leche materna, se debe tener precaución cuando se administre Solución oftálmica de HCl de Epinastina al 0,05% a una mujer lactante.
Uso pediátrico
No se ha establecido la seguridad y eficacia en pacientes pediátricos menores de 2 años.
Uso geriátrico
No se han observado diferencias generales en la seguridad o la eficacia entre los pacientes de edad avanzada y los más jóvenes.
Epinastine HCl, Solución Oftálmica Descripción
Epinastine HCl, Solución Oftálmica 0.05% is a clear, colorless, sterile isotonic solution containing epinastine HCl, an antihistamine and an inhibitor of histamine release from the mast cell for topical administration to the eyes.
Epinastine HCl is represented by the following structural formula:
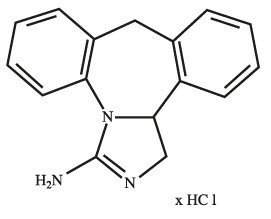
C16H15N3HCl Mol. Wt. 285.78
Chemical Name:
3-Amino-9,13b-dihydro-1H-dibenzimidazoazepine hydrochloride
Each mL contains: Active: Epinastine HCl 0.05% (0.5 mg/mL) equivalent to epinastine 0.044% (0.44 mg/mL); Preservative: Benzalkonium chloride 0.01%; Inactives: Edetato disódico, dihidrato; agua purificada; cloruro de sodio; fosfato de sodio, monobásico, anhidro; e hidróxido de sodio y/o ácido clorhídrico (para ajustar el pH).
Solución oftálmica de HCl de Epinastina al 0,05% tiene un pH de aproximadamente 7 y un rango de osmolalidad de 250 a 310 mOsm/kg.
Solución oftálmica HCl de Epinastina-Farmacología clínica
Mecanismo de acción
La epinastina es un antagonista directo del receptor H1 activo por vía tópica y un inhibidor de la liberación de histamina de los mastocitos. La epinastina es selectiva para el receptor H1 de histamina y tiene afinidad por el receptor H2 de histamina. La epinastina también posee afinidad por los receptores α1, α2 y 5-HT2.
Farmacocinética
Catorce sujetos, con conjuntivitis alérgica, recibieron una gota de Solución oftálmica de ácido clorhídrico de Epinastina al 0,05% en cada ojo dos veces al día durante 7 días. En el día 7, se alcanzaron concentraciones plasmáticas máximas medias de epinastina de 0,04±0,014 ng/ml después de aproximadamente dos horas, lo que indica una exposición sistémica baja. Aunque estas concentraciones representaron un aumento con respecto a las observadas tras una dosis única, los valores del Área Bajo la Curva (AUC) del día 1 y del día 7 no se modificaron, lo que indica que no hay aumento de la absorción sistémica con dosis múltiples. La epinastina se une en un 64% a las proteínas plasmáticas. El aclaramiento sistémico total es de aproximadamente 56 L/h y la semivida de eliminación plasmática terminal es de aproximadamente 12 horas. La epinastina se excreta principalmente inalterada. Aproximadamente el 55% de una dosis intravenosa se recupera inalterada en la orina y aproximadamente el 30% en las heces. Menos del 10% se metaboliza. La eliminación renal se produce principalmente a través de la secreción tubular activa.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Alteración de la fertilidad
En estudios de carcinogenicidad dietética de 18 meses o 2 años en ratones o ratas, respectivamente, la epinastina no fue carcinógena a dosis de hasta 40 mg / kg.
La epinastina en lotes recién sintetizados fue negativa para mutagenicidad en el ensayo de Ames / Salmonella y en el ensayo de aberración cromosómica in vitro con linfocitos humanos. Se observaron resultados positivos con los primeros lotes de epinastina en dos estudios de aberración cromosómica in vitro realizados en la década de 1980 con linfocitos periféricos humanos y con células V79, respectivamente. La epinastina fue negativa en los estudios de clastogenicidad in vivo, incluido el ensayo de micronúcleos de ratón y el ensayo de aberración cromosómica en hámsters chinos. La epinastina también fue negativa en el ensayo de transformación celular con células embrionarias de hámster sirio, en el ensayo de mutación puntual de células de mamíferos V79/HGPRT y en el ensayo de síntesis de ADN no programada in vivo/in vitro con hepatocitos primarios de rata.
La epinastina no tuvo efecto sobre la fertilidad de ratas macho. Se observó una disminución de la fertilidad en ratas hembra a dosis orales de hasta aproximadamente 90.000 veces la ERM.
Estudios clínicos
Se ha demostrado que el HCl de epinastina al 0,05% es significativamente superior al vehículo para mejorar la picazón ocular en pacientes con conjuntivitis alérgica en estudios clínicos que utilizaron dos modelos diferentes: (1) desafío de antígeno conjuntival (CAC) donde se administró a los pacientes y luego se les infundió antígeno en el fórnix conjuntival inferior; y (2) estudios ambientales de campo donde los pacientes fueron dosificados y evaluados durante la temporada de alergias en su hábitat natural. Los resultados demostraron un rápido inicio de acción del HCl de epinastina al 0,05% entre 3 y 5 minutos después de la exposición al antígeno conjuntival. Se demostró que la duración del efecto era de 8 horas, por lo que un régimen de dos veces al día era adecuado. Esta pauta posológica demostró ser segura y eficaz durante un máximo de 8 semanas, sin evidencia de taquifilaxis.
Cómo se suministra / Almacenamiento y manipulación
Solución Oftálmica HCl de Epinastina 0.el 05% se suministra estéril en frascos de plástico LDPE blanco opaco con puntas cuentagotas y tapas blancas de polipropileno (PP) de la siguiente manera:
| 5 mL en frasco de 10 ml | NDC 51991-836-75 |
Almacenamiento: Almacenar a 20° – 25°C (68° – 77°F) . Mantenga el frasco bien cerrado y fuera del alcance de los niños.
Información de asesoramiento para pacientes
Esterilidad de la punta del gotero
Se debe aconsejar a los pacientes que no toquen la punta del gotero en ninguna superficie, ya que esto puede contaminar el contenido (ver ADVERTENCIAS Y PRECAUCIONES, 5.1).
Uso concomitante de lentes de contacto
Se debe aconsejar a los pacientes que no usen lentes de contacto si sus ojos están rojos. Se debe advertir a los pacientes que la Solución oftálmica de HCl de Epinastina al 0,05% no se debe utilizar para tratar la irritación relacionada con las lentes de contacto. Los pacientes también deben ser advertidos para quitar las lentes de contacto antes de la instilación de Epinastine HCl, Solución Oftálmica 0.05%.
El conservante en Solución oftálmica HCl de Epinastina al 0,05%, cloruro de benzalconio, puede ser absorbido por lentes de contacto blandas. Las lentes se pueden volver a insertar después de 10 minutos después de la administración de Solución Oftálmica HCl de Epinastina al 0,05%
Uso oftálmico tópico Solamente
Para administración oftálmica tópica solamente.
Solo Rx
Distribuido por:
Breckenridge Pharmaceutical, Inc.
Berlin, CT 06037
Fabricado por:
PrimaPharma, Inc.
San Diego, CA 92121
Rev: 04/2020
2323 04/20
PRINCIPAL DISPLAY PANEL – 5 mL Bottle Carton
NDC 51991-836-75
Epinastine HCl
Ophthalmic
Solution,
0.05%
FOR USE IN THE
EYES ONLY
sterile
Rx Only
5 mL sterile
breckenridge
A Towa
Company

| EPINASTINE HYDROCHLORIDE epinastine hydrochloride solution/ drops |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Labeler – Breckenridge Pharmaceutical, Inc. (150554335)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| PrimaPharma, Inc. | 079699106 | MANUFACTURE(51991-836) | |
More about epinastine ophthalmic
- Side Effects
- During Pregnancy or Breastfeeding
- Dosage Information
- Pricing & Coupons
- En Español
- 3 Reviews
- Drug class: antihistamínicos y descongestionantes oftálmicos
Recursos para el consumidor
- Información para el paciente
- Epinastina Oftálmica (Lectura Avanzada)
Recursos profesionales
- Información de prescripción
- Epinastina (Asesoramiento Profesional para el Paciente)
Otras marcas Elestat
Guías de tratamiento relacionadas
- Conjuntivitis alérgica
Descargo de responsabilidad médico