dipolit
ymmärtääksemme ei-kovalenttisten vuorovaikutusten luonteen meidän on ensin palattava kovalenttisiin sidoksiin ja pureuduttava dipolien aiheeseen. Monissa näkemissämme kovalenttisissa sidoksissa-esimerkiksi kahden hiilen välillä tai hiilen ja vedyn välillä –elektronit jakautuvat suunnilleen yhtä paljon sidoksen kahden atomin kesken. Näissä esimerkeissä kahdella atomilla on suunnilleen sama elektronegatiivisuus. Muista kemian kurssiltasi, että elektronegatiivisuudella tarkoitetaan ”atomin voimaa molekyylissä vetää elektroneja puoleensa” (tämä on Linus Paulingin tarjoama määritelmä, etevä 1900-luvun amerikkalainen kemisti, joka oli ensisijaisesti vastuussa monien oppimiemme sidoskonseptien kehittämisestä).
orgaanisessa kemiassa käsitellään kuitenkin melko usein kovalenttisia sidoksia kahden eri elektronegatiivisuudella varustetun atomin välillä, ja näissä tapauksissa elektronien jakaantuminen ei ole yhtä suuri: elektronegatiivisempi ydin vetää kahta elektronia lähemmäksi. Esimerkiksi alkoholin hiili-happi-sidoksessa Sigma-sidoksen kaksi elektronia ovat tiiviimmin kiinni hapessa kuin hiilessä, koska happi on huomattavasti elektronegatiivisempi kuin hiili. Sama pätee happi-vety-sidokseen, sillä vety on hieman vähemmän elektronegatiivista kuin hiili ja paljon vähemmän elektronegatiivista kuin happi.
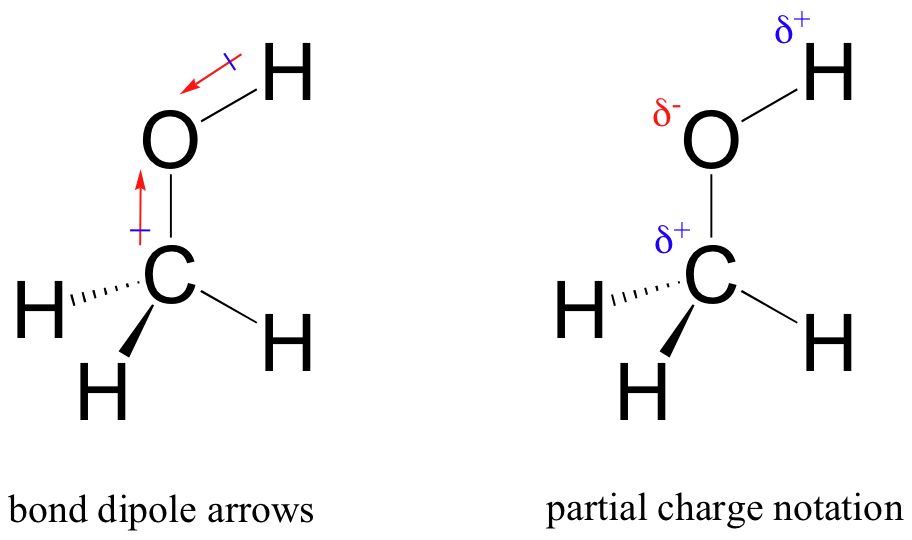
tämän epätasaisen jakautumisen tuloksena on niin sanottu sidosdipoli, joka esiintyy polaarisessa kovalenttisessa sidoksessa. Sidos – dipolilla on sekä negatiivisia että positiivisia päitä eli napoja, joissa elektronitiheys on pienempi (positiivinen napa) ja korkeampi (negatiivinen napa). Elektronitiheyden ero voidaan ilmaista käyttämällä kreikkalaista Delta-kirjainta merkitsemään ”osittaispositiivista” ja ”osittaisnegatiivista” varausta atomeille. ”Dipolinuolia”, joiden pyrstössä on positiivinen merkki, käytetään myös osoittamaan Dipolin negatiivista (korkeampaa elektronitiheyttä) suuntaa.
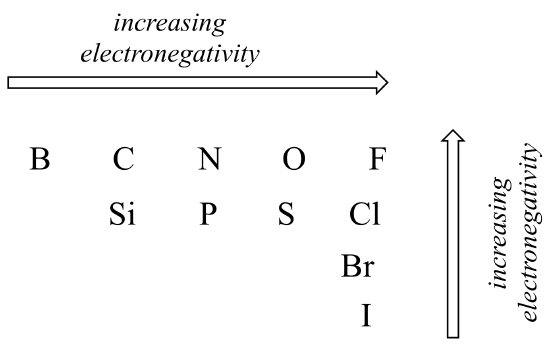
napaisuuden aste kovalenttisessa sidoksessa riippuu kahden atomin välisestä elektronegatiivisuuserosta. Elektronegatiivisuus on jaksollinen suuntaus: se kasvaa menee vasemmalta oikealle koko rivin jaksollisen järjestelmän elementtejä, ja myös kasvaa, kun siirrymme ylös sarake. Siksi happi on elektronegatiivisempi kuin typpi, joka puolestaan on elektronegatiivisempi kuin hiili. Happi on myös elektronegatiivisempaa kuin rikki. Jaksollisen järjestelmän oikeassa yläkulmassa oleva fluori on alkuaineista elektronegatiivisin. Vety on hieman vähemmän elektronegatiivista kuin hiili.
elektronegatiivisuuden jaksolliset trendit
harjoitus 2.26
käyttäen mitä atomiorbitaaleista, rationalisoi elektronegatiivisuuden jaksolliset trendit. Miksi se kasvaa vasemmalta oikealle ja laskee ylhäältä alas? Tämä on hyvä kysymys puhua läpi luokkatovereiden ja ohjaaja tai ohjaaja.
harjoitukset
useimmat molekyylit sisältävät sekä polaarisia että ei-polaarisia kovalenttisia sidoksia. Polaarisidosten sijainnista ja sidosgeometriasta riippuen molekyyleillä voi olla nettopolaarisuus, jota kutsutaan molekyylidipolimomentiksi. Kuten luultavasti muistatte, vedellä on dipolimomentti, joka johtuu sen kahden happi-vetysidoksen Yhdistyneistä dipoleista. Fluorimetaanilla on myös dipolimomentti.
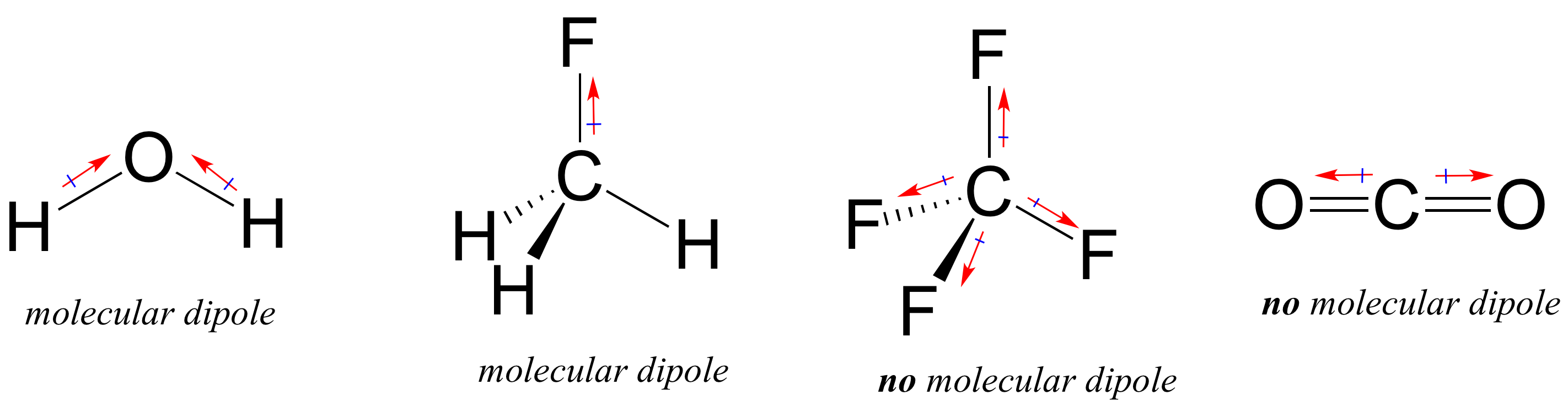
Tetrafluorimetaanilla on kuitenkin neljä polaarista sidosta, jotka vetävät tasaisesti tetaedrin neljään kulmaan, eli vaikka sidoksia on neljä, ei ole yleistä molekyylidipolimomenttia. Hiilidioksidilta puuttuu myös molekyylidipolimomentti.
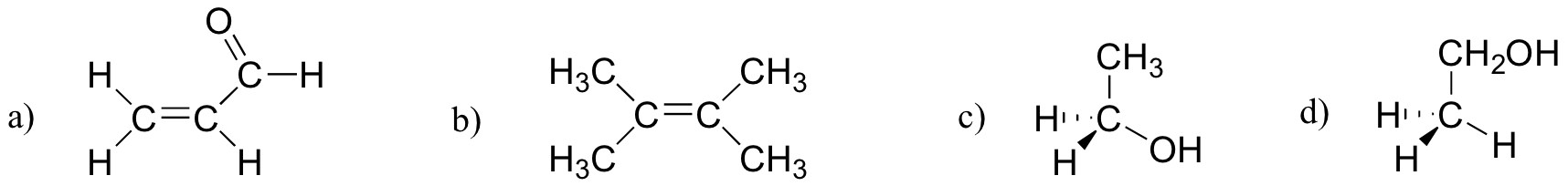
harjoitus 2,27
millä alla olevista molekyyleistä on molekyylidipolimomentteja?
ratkaisut harjoituksiin